
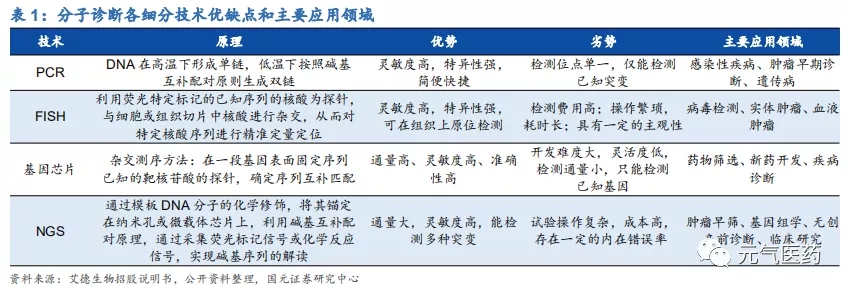
? 分子診斷引領 IVD 快速發展,應用場景多樣化
分子診斷是 IVD 領域發展最快的細分領域,2019 年國內市場規模達 132.1 億元,年復合增長率達到 31.63%。分子診斷技術和應用場景多樣化,不同場景處在不同的發展階段、擁有不同的判斷邏輯:
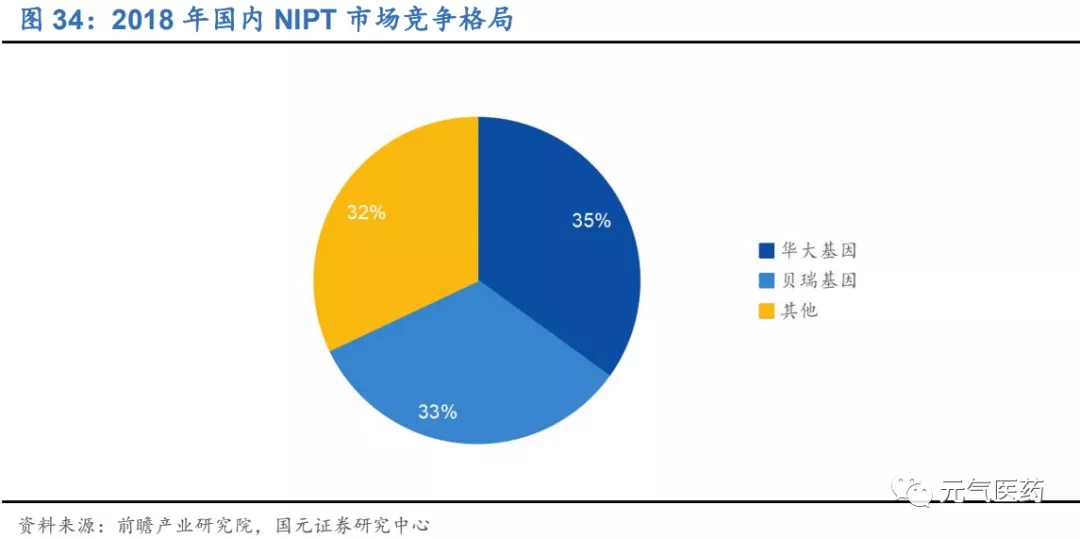
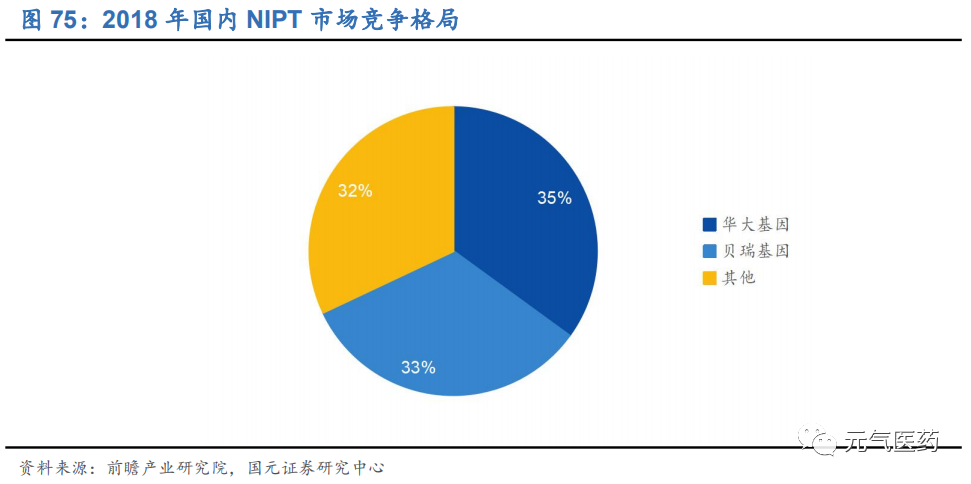
NIPT:NGS 技術的發展典范,發展相對成熟,已進入市場認知較高、醫保支持覆蓋階段,滲透率繼續提升、產品升級換代為主要成長邏輯。貝瑞基因和華大基因寡頭壟斷,先發優勢顯著。預計 2025 年國內 NIPT 市場規模將達到約 100 億元。
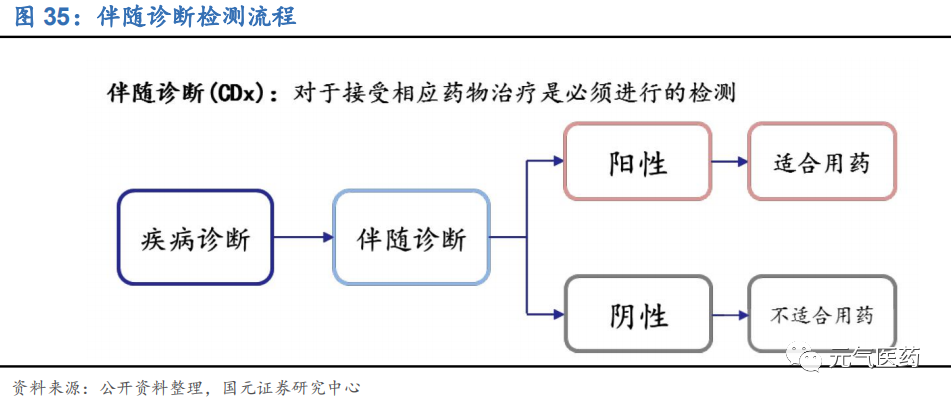
伴隨診斷:多種檢測手段并行,目前以 PCR 為主,NGS 是未來方向,在技術發展、新靶點和新靶向藥物發現、伴隨診斷產品納入醫保等驅動力下,檢測市場仍有量價齊升空間。代表企業包括艾德生物、燃石醫學、泛生子等。
腫瘤早篩:“藍海”市場,理論市場空間大。從技術上來看,液體活檢發展是核心,從市場上來看,精準定位需求是關鍵。
? 腫瘤早篩是概念還是有前景?
早篩的目標群體主要是健康人群,較腫瘤患者群體更具有群眾基礎;同時,腫瘤早篩成熟化產品尚未形成,早篩理論前景可期。我們認為能夠率先走出來的產品需要精準抓住需求點及診療路徑,如貝瑞基因 PreCar 肝癌早篩項目:1)精準定位需求:以潛在高危人群為主,相較于普通健康人群,具有更高意愿進行肝癌相關早篩。2)精準定位診療路徑:應用場景可拓展至醫院院內,不局限于體檢機構及一年一 次的體檢頻率。
? PCR vs NGS:優勢互補,長期共存
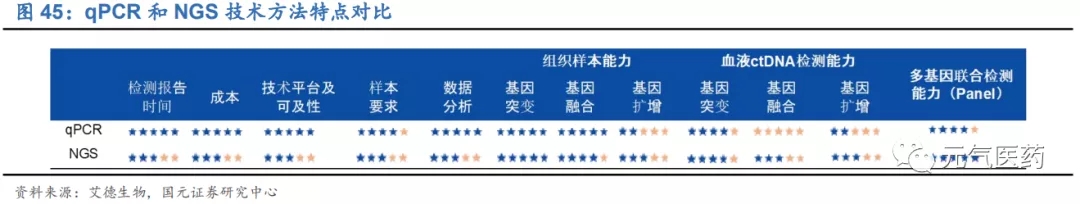
NGS 存在部分技術瓶頸尚未解決、成本較高、入院困難、醫保覆蓋范圍有限等諸多難題,對 PCR 市場份額的沖擊較小。從基因檢測數量看,PCR 能滿足現有檢測需求,NGS 適合高通量檢測需 求;PCR 和 NGS 在應用場景是重疊度較低,PCR 和 NGS 在不同細分領域“各領風騷”。因此我們認為,短中期來看,PCR 和 NGS 之間是優勢互補、相輔相成、共存發展而并非替代的關系,目前 PCR 仍將是主流的分子診斷平臺,NGS 是未來發展的重要趨勢。
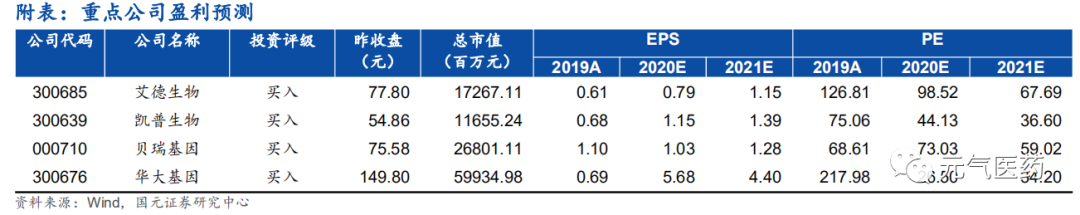
? 投資建議與盈利預測
考慮到分子診斷市場蓬勃發展、技術革新,我們給予行業推薦評級。重點推薦 PCR+NGS 雙布局的艾德生物、NIPT 現金流+肝癌早篩產品即將落地的貝瑞基因和專注婦幼檢測龍頭凱普生物,建議關注國內基因測序服務龍頭華大基因及關聯上游企業華大智造;腫瘤 NGS 檢測上市龍頭企業 燃石醫學、泛生子及擬上市世和基因、諾禾致源。
?風險提示
公司產品研發不及預期、政策風險、新冠疫情風險。

投資摘要:IVD 黃金賽道,百億級市場蓄勢待發
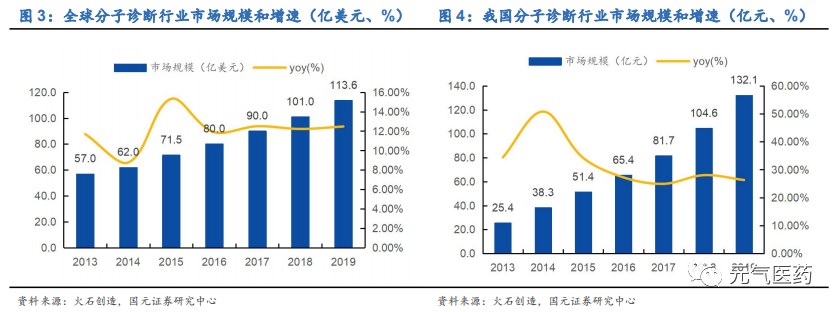
分子診斷是發展最快的 IVD 細分領域,國內分子診斷市場廣闊、增長迅猛。相比生化診斷、免疫診斷等,分子診斷憑借檢測時間短、靈敏度更高、特異性更強等優勢,在精準醫療和個性化治療需求的推動下,成為 IVD 賽道發展最快的細分領域。2013-2019 年,我國分子診斷市場規模由 25.4 億元增長至約 132.1 億元,年復合增長率達到 31.63%, 呈現快速增長態勢,雖然僅占全球市場規模的 16.86%,但是增速約為全球增速的 2.6 倍。
分子診斷應用場景多樣化,覆蓋生育健康檢測、腫瘤全周期檢測、傳染病檢測等多個領域,本報告重點梳理了幾個 投資者較為關注的熱門領域進行剖析,主要包括:
(1)無創產前診斷(NIPT):NIPT 是 NGS 應用成熟的典范領域,相比傳統的血清學唐篩,NIPT 具有檢出率高、 流產風險低、檢測周期短、操作簡便等諸多優勢,市場廣闊而成熟。NIPT 檢測范圍隨著技術的發展不斷擴大, 貝瑞基因、華大基因等龍頭企業推出的 NIPT Plus 升級產品將檢測范圍拓展至更多的染色體數量或結構異常、 甚至單基因遺傳病,更好地契合不同的臨床需求。隨著國內對 NIPT 監管從無序到有序、越來越多省份將 NIPT 納入醫保或降低價格,NIPT 開始進入大眾價時代。國內貝瑞基因和華大基因憑借先發優勢和技術優勢寡頭壟斷,市場競爭格局已趨于穩定。
(2)腫瘤伴隨診斷:伴隨診斷(CDx)是靶向用藥、實現精準治療的關鍵因素。目前仍以 PCR 為主,FDA 批準的 39 個 CDx 產品中有 15 個是基于 PCR,NGS 是未來方向,2018 年燃石醫學、諾禾致源、世和基因、艾德生 物四家企業的腫瘤 NGS 檢測試劑盒先后獲批,標志著國產 NGS 伴隨診斷產品開始邁入市場化階段,PCR 和 NGS 將齊頭并進、共同發展。目前伴隨診斷滲透率不足 50%,根據我們測算,肺癌、胃癌等 6 個癌種的 PCR+NGS 伴隨診斷市場規模合計約 39 億元,隨著大 Panel 和 NGS 產品滲透率提升,以及更多靶點和相應靶向藥物的發現,伴隨診斷市場有望進一步擴容。國內艾德生物憑借多年的技術優勢和產品布局成為伴隨診斷行業領跑者,產品管線豐富,核心競爭力強,渠道和品牌優勢明顯,PCR 領域基本實現進口替代;燃石醫學是國內腫瘤 NGS 伴隨診斷領域龍頭,憑借核心技術優勢于 2018 年拿下國產“腫瘤 NGS 試劑盒第一證”,目前 在腫瘤 NGS 伴隨診斷市占率第一。
(3)腫瘤早篩:現有早篩手段多具有一定局限性,多數癌種尚無有效監測手段,我國早篩“藍海”市場理論市場空間大,巨大潛在需求吸引國內外企業加速布局并搶占市場份額。從全球企業布局來看,全球頭部公司多處于產品研發優化及驗證階段,Grail、Freenome 和 Thrive 等高科技公司走在前列。國內企業尚處于起步階段,早篩的臨床驗證需要較高的研發投入,其中貝瑞基因和燃石醫學等企業進度領先。貝瑞基因的 PreCar 肝癌早篩項目預計 2020 年8月將以 LTD 的形式落地,預計有望成為早篩成功標桿。燃石醫學主要在泛癌種早篩方向發力,包括肺癌、腸癌和肝癌三種,基于深度甲基化測序與機器學習技術,公司開展了國內迄今為止最大規模的前瞻性、泛癌種早檢研究,預期納入 1.4 萬受試者,并計劃在三年內完成早篩產品的技術優化及臨床驗證。在政策、技術和市場需求的驅動下,國內早篩市場有望迎來蓬勃發展。
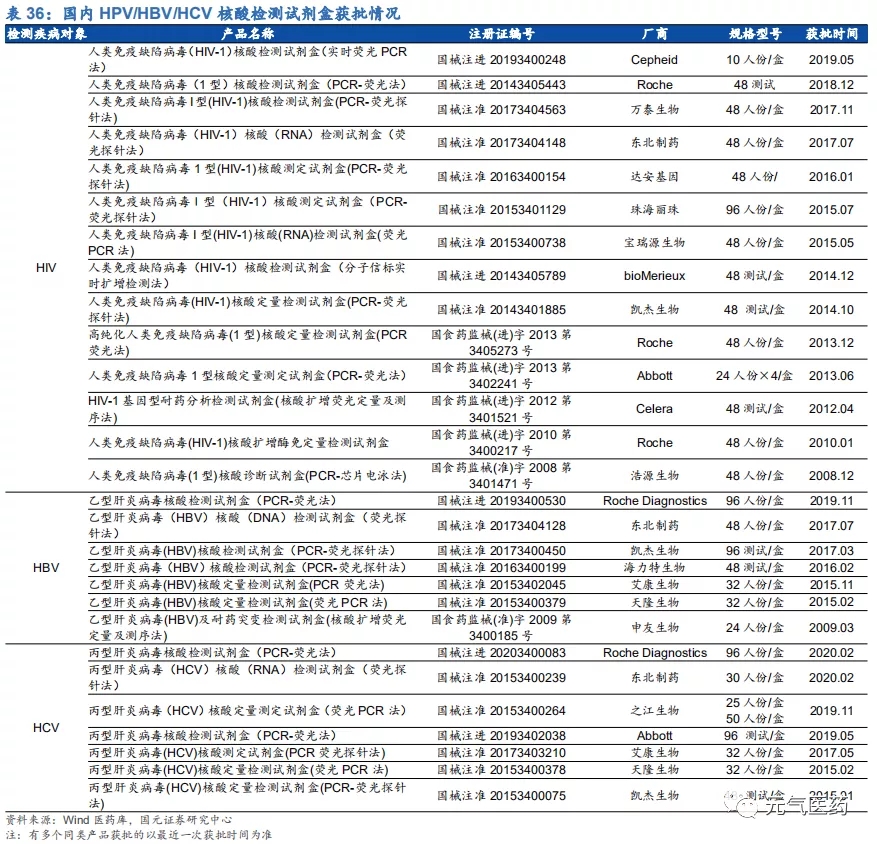
(4)傳染病檢測(新冠檢測+血液篩查):2020 年疫情期間,新冠核酸檢測試劑成為遏制疫情傳播的有力手段,核酸檢測是確診新冠肺炎的“金標準”。隨著海內外疫情先后蔓延,檢測試劑需求激增,大規模篩查已成常態化,國家先后啟動了試劑集采、鼓勵各地二級以上醫院建設 PCR 實驗室等政策,檢測成本、試劑日產能、日平均檢測量均有了大幅提升,截止 2020 年 7 月底,全國累計核酸檢測量已達 1.6 億人份,核酸檢測試劑周產能達 到 4648 萬人份,充分保障了國內核酸檢測常態化需求。新冠檢測市場規模較大,市場競爭激烈,集采中以價換量、保證產品質量以及拿到海外出口批文將成為國內相關企業業績增厚的關鍵因素,預計 2020 年下半年甚至 2021 年,邁克生物、之江生物、達安基因等核酸檢測試劑供應商以及迪安診斷、金域醫學等第三方檢測實驗室將持續受益。血液篩查主要應用于血站和漿站,我們預計2020-2022 年血液核酸檢測市場規模將穩定在 26 億元左右。從競爭格局看,國內血篩檢測試劑銷售以政府招標為主,各家產品同質程度高,因此渠道優勢、成本優勢、儀器投放能力將成為國內廠商中標的主要因素,科華生物、達安生物、上海浩源等老牌國產企業以及羅氏、諾華等進口企業或持續受益。
針對市場討論比較關注的問題,我們也嘗試做一些淺析,以供參考:
1.無創產前篩查(NIPT)的天花板是否到達?增量空間從何而來?
市場多數認為 NIPT 市場已經發展成熟,每年新生兒數量趨于穩定甚至呈現一定的下降趨勢,天花板已現。但我們考慮,NIPT 市場成長不僅僅取決于新生兒數量,而是隨著技術發展帶來的疾病譜篩查擴大、以及認知度和保障度改善 帶來的滲透率提升:
NIPT 檢測范圍擴大:現有獲批 NIPT 產品主要檢測 13、18 和 21 號染色體的非整倍體異常,隨著貝瑞基因、 華大基因等公司的 NIPT Plus 產品升級,檢測范圍將從 3 種常見非整倍體數目異常的檢測至其他染色體非整 倍體異常、染色體微缺失/微重復、單基因遺傳病檢測等,市場空間廣闊。
醫保支付覆蓋+孕婦檢測意識的提升雙輪驅動 NIPT 市場擴容:隨著 NIPT 進入技術成熟階段,檢測費用有所 下調,同時醫保逐步覆蓋,較大程度上有助于提升可及性。2013 年,深圳市率先將 NIPT 檢測項目納入醫保 范疇,極大提高了 NIPT 檢測的認知度和滲透率。從 2016 年數據來看,非高齡孕婦中 NIPT 的滲透率僅有 3%, 仍有較大提升空間。目前,僅有 10 個省份將 NIPT 納入醫保。
因此,根據我們測算,目前 NIPT 在高齡產婦中滲透率為 35%,非高齡產婦中滲透率為 15%,全市場規模為 40.03 億。預計隨著醫保覆蓋提升、產品升級換代,2025 年我國 NIPT 市場規模有望達到約 100 億元,仍有超過一倍提升空間。
2.腫瘤早篩前景如何判斷?玩家眾多,誰才是“王者”?
腫瘤早篩相較于“擁擠”的腫瘤個體化治療更加受到市場青睞,一方面,早篩的目標群體主要是健康或亞健康人群,較腫瘤患者群體更具有群眾基礎;另一方面,腫瘤早篩市場仍然處于“藍海”,成熟化產品尚未形成,早篩理論前景可期。
千億級潛在市場吸引國內外企業加速布局早篩業務,而我們認為能夠率先走出來的產品需要精準抓住需求點及診療路徑。貝瑞基因 PreCar 肝癌早篩項目走在國內外研發前列,經過多年的高研發投入和大規模前瞻性驗證實驗,其早篩產品即將步入收獲期,將于 2020 年8月以 LTD(第三方檢測服務)的形式落地。
我們看好貝瑞基因 PreCar 肝癌早篩項目,預計有望成為早篩成功標桿:
1)精準定位需求:以潛在高危人群為主,如容易發展成肝癌的已知肝硬化、肝纖維化、肝炎患者,相較于普通健康人群,具有更高意愿進行肝癌相關早篩。
2)精準定位診療路徑:應用場景可拓展至醫院院內,不局限于體檢機構及一年一次的體檢頻率。肝癌高危人群通常需要維持每季度/半年一次的肝功能相關檢查,PreCar 肝癌早篩項目可進院嫁接在常規隨訪上。
肝癌早篩主要針對高危人群,其中肝硬化患者和乙肝/丙肝患者是主要潛在適用群體,根據我們對未來 10 年早篩理論市場規模的測算,2025 年有望達到 33 億元左右,2030 年有望達到約 144 億元(具體測算邏輯見 2.3 章節)。
3.伴隨診斷未來市場驅動力?
伴隨診斷賽道景氣度高,天花板尚遠。不管是技術發展層面還是應用癌種和靶點層面,伴隨診斷市場尚處于快速發展階段,在 NGS 和液體活檢技術不斷突破、新靶點和新靶向藥物的不斷發現、醫保端對靶向藥物和伴隨診斷產品的覆蓋趨勢等驅動力下,行業持續發展驅動力強,景氣度高:
NGS 和液體活檢技術突破:PCR 技術目前已較為成熟,但主要用于已知突變,且一次性檢測基因數量有限, 而 NGS 最大的優勢就是高通量,可實現大 Panel 檢測。2020 年 8 月,FDA 批準了首個基于 NGS 技術的癌癥液體活檢產品,可同時檢測 55 個腫瘤基因的突變;2020 年 7 月,貝瑞基因發布大 Panel 基因檢測產品“和 全安”,可同時檢測 654 個基因。未來隨著更多基因大 Panel 產品的推出,有望帶動價格提升;
新靶點和新靶向藥物的發現:從行業發展階段來看,目前精準醫療仍處于發展早期,最為成熟的肺癌領域目前也在不斷發展中,耐藥機制也使突變位點不斷增加,并出現 T790M、MET 等可成藥的突變類型。此外,隨著新藥研發力度的增強,KRAS G12C、NTRK 等位點也正在被不斷攻克中,伴隨診斷產品也將不斷豐富,市場有望進一步擴大;
醫保對靶向藥物和 CDx 產品的覆蓋趨勢:2017 年起醫保局連續開啟了三輪醫保談判降價,大部分主流靶向藥價格得到了大幅度的下降,靶向藥物納入醫保范圍且降價明顯,或帶動伴隨診斷產品滲透率提升。2018 年 12 月,北京醫保局率先將腫瘤組織 DNA 測序納入醫保乙類,并限定價格為 3800 元。隨著未來更多的省份將 CDx 產品納入醫保,可及性或大幅提升。
4. NGS 爆發時代已來?PCR 已經過氣了?
NGS 近幾年發展迅速,在腫瘤基因檢測應用前景廣闊,廣受資本市場的青睞,吸引大量企業布局 NGS 領域。市場 上有聲音認為 PCR 技術已經過時,NGS 將逐步取代 PCR 成為主流分子診斷技術。但我們認為,短中期來看,PCR 和 NGS 之間是優勢互補、相輔相成、共存發展而并非替代的關系,目前 PCR 仍將是主流的分子診斷平臺,NGS 是未來發展的重要趨勢。
NGS 仍存在諸多瓶頸尚未攻克,對現有 PCR 市場沖擊較小:
1)部分技術瓶頸問題尚未解決,比如讀長普遍較低、序列拼接過程中錯誤率在 0.1-15%范圍內等;
2)監管層尚未明確定義和批復高通量 NGS 產品,“無證”產品居多,入院困難,僅以 LDT 形式存在;
3)NGS 尚未成為精準治療的必需手段,PCR 等其他分子診斷手段尚可滿足;
4)上游檢測設備、核心試劑仍掌握在海外寡頭企業,成本居高,影響企業盈利性,有待觀察行業上游設備企業發展情況,如華大智造、博奧晶典等;
5)醫保覆蓋范圍局限,影響產品可及性。
從基因檢測數量看,PCR 能滿足現有基因檢測需求,NGS 適合高通量檢測需求:就目前靶向治療現有靶點而言,已上市藥物的靶點數均不超過 10 個,即使在靶向藥物最豐富的肺癌,現有市場 PCR 檢測產品(比如艾德生物的“艾惠健”)也能滿足目前已上市甚至未來 3-5 年潛在上市靶向藥物所有核心驅動基因,滿足大部分人群需求。NGS 的主要優勢是高通量,適合大 Panel 檢測領域,滿足少數人的需求,而 TMB 等高通量需求尚未被“正名”。以伴隨診斷為例, 基因檢測的目的是通過檢測突變基因從而預測靶向藥物效果,當測序覆蓋足夠靶點基因后,再增加基因檢測數量對提供靶向用藥指導并無益處,檢測剛需性不足。
PCR 和 NGS 應用場景重疊度低:基因檢測應用場景廣泛,PCR 和 NGS 在不同細分應用領域“各領風騷”。PCR 普及度高、檢測時間短、成本低的特性決定了其在包括新冠檢測、血液篩查在內的傳染病檢測領域具有請務必閱讀NGS 不可比擬的優勢。此外,PCR 適合基因位點已知、對靈敏度要求較高的檢測,而 NGS 在發現未知基因、 液體活檢方面則更具優勢。
1. 分子診斷:多技術共存,引領體外診斷快速發展
1.1 分子診斷-發展最快的 IVD 細分領域
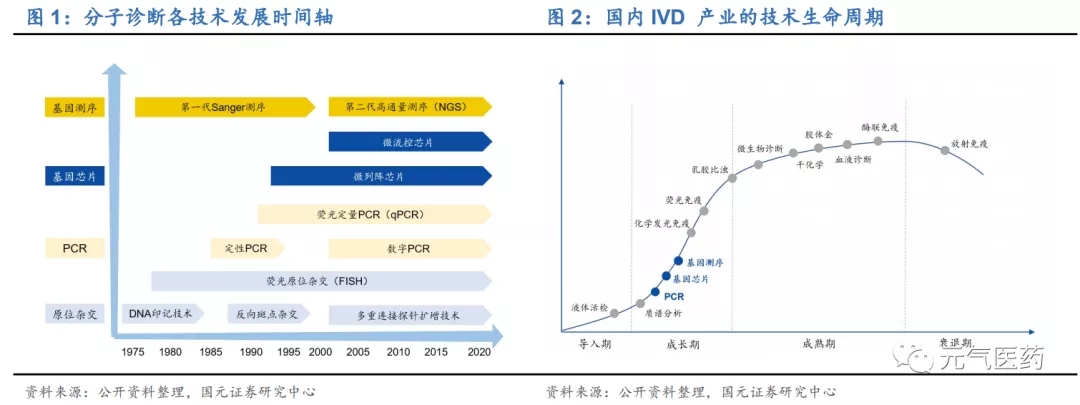
分子診斷是應用分子生物學方法,通過檢測受檢個體或其攜帶病毒、病原體的遺傳物質的結構或含量的變化而做出診斷的技術。其檢測對象主要為核酸和蛋白質,以核酸分子為主,相比于發展成熟的免疫診斷、生化診斷等技術,分子診斷處于快速成長期,是體外診斷(In Vitro Diagnosis, IVD)領域發展最快的細分領域,具有檢測時間短、靈敏度更高、特異性更強等優勢,被廣泛應用于傳染性疾病、血液篩查、 遺傳性疾病、腫瘤伴隨診斷等領域。分子診斷技術的發展經歷了四個階段:
(1)第一階段:20 世紀 80 年代基于核酸分子雜交技術的遺傳病診斷;
(2)第二階段:20 世紀 90 年代聚合酶鏈式反應(PCR)的問世將分子診斷技術 推向更精準、更高效的階段特別是發展到第二代的熒光定量 PCR(qPCR)和第三代的數字 PCR(dPCR);
(3)第三階段是基于基因芯片的多指標、高通量基因檢測;
(4)第四階段是基于基因測序技術在 NIPT(無創產前診斷)、遺傳性腫瘤篩查及腫瘤精準治療等方面的應用。
國內分子診斷起步較晚,發展速度高于全球。在精準醫療、個性化用藥等需求推動下,分子診斷技術在全球得到飛速發展,根據火石創造數據顯示,2013-2019 年全球分子診斷市場規模由 57 億美元增長至 113.6 億美元,年復合增長率為12.18%,主要市場玩家包括羅氏、雅培、西門子、強生等。國內分子診斷雖然起步較晚,但在消費升級、政策扶持以及資本青睞等多重因素推動下,已經由產業導入期步入成長期。2013-2019 年,我國分子診斷市場規模由 25.4 億元增長至約132.1 億元,年復合增長率達到 31.63%,雖然僅占全球市場規模的 16.86%,但是增速約為全球增速的 2.6 倍,主要企業包括達安基因、凱普生物、華大基因、貝瑞基因、艾德生物等。
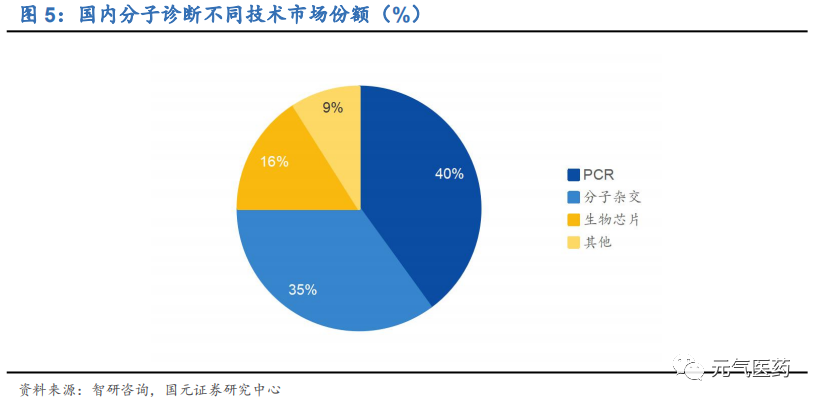
分子診斷領域主要包括 PCR(qPCR 和 dPCR)、二代測序技術(NGS)、熒光原位雜交(FISH)、基因芯片等, 其中 PCR 是目前應用最成熟、市場份額最大的技術平臺,在國內分子診斷中市占率為 40%,在國內獲批的分子診斷產品中,基于 PCR 技術的超過 90%。與雜交技術和測序技術相比,PCR 技術主要優勢在于高靈敏度、易于推廣, 主要局限在于檢測位點單一且已知,多重基因聯合檢測時可涵蓋的基因數量受限,目前已經發展到第三代數字 PCR (dPCR),短期內仍將是分子診斷主流技術平臺;測序技術發展迅猛,雖然市占率較低但市場增速最快,其中二代測序技術 NGS(高通量測序)是目前測序領域應用最廣泛的技術,已經成為許多序列變異分析與科研應用的主要選擇,但由于實驗操作復雜、成本高等原因,在臨床應用中仍處于起步階段,應用前景廣闊。
1.2 PCR:分子診斷主流技術平臺,臨床診斷“金標準”
PCR(聚合酶鏈式反應)是指利用 DNA 聚合酶(如 Taq DNA 聚合酶)在體外條件下,催化一對引物間的特異 DNA 片段合成的基因體外擴增技術。PCR 是生物體外的特殊 DNA 復制,最大的特點是能將微量的 DNA 大幅擴增。以實 時熒光 PCR 技術為例,通過 PCR 技術進行分子診斷的主要流程包括:
1. 核酸的提取和純化:使用核酸提取試劑從病毒、細菌等中提取出 DNA;
2. 核酸在引物約束下特異性的 PCR 擴增:在提取的 DNA 中加入擴增需要的反應液(酶、復制需要的原料、引物 等),在 PCR 儀中完成擴增過程;
3. 擴增產物的檢測:通過熒光標記法檢測 DNA 含量,從而判斷病毒 DNA 含量,給出診斷結果。

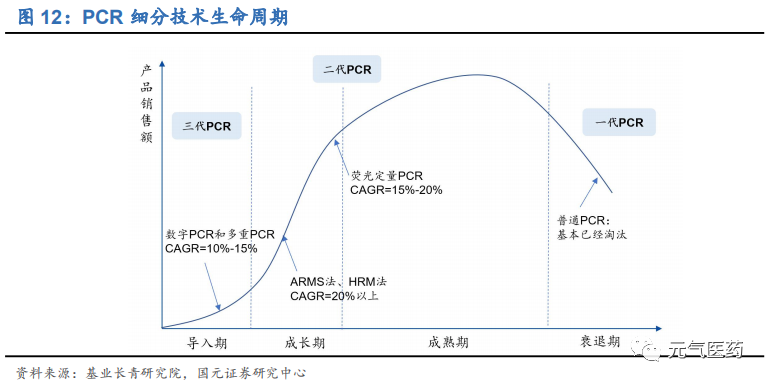
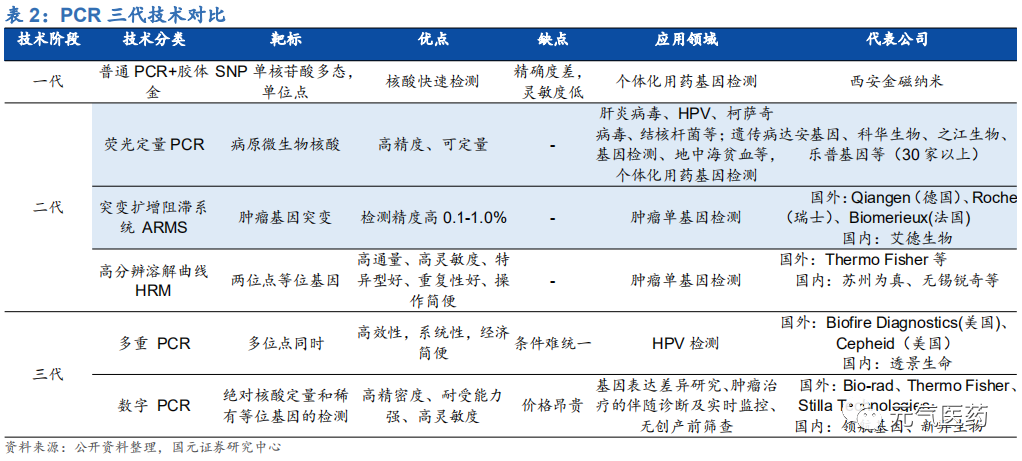
PCR 技術最大的特點就是靈敏度高、特異性好、及時方便,在基礎研究以及醫學診斷、法醫學和農業科學等各大領域應用廣泛。在臨床診斷中,PCR 技術具有諸多優勢:靈敏度高,靶細胞檢出率可達 1/100 萬,病毒檢測靈敏度≥ 3RFU,最小細菌檢出率為 3 個,檢測樣本純度要低,僅需 DNA 粗提取;擴增反應在 2-4 小時內完成,使用簡便、快捷。作為臨床診斷的“金標準”技術,PCR 廣泛應用于血站核酸檢測、疾控核酸檢測、臨床核酸檢測等領域,其中, 在傳染病診斷和血篩檢測中,PCR 技術能縮短診斷的“窗口期”并且可以定量對病原體進行檢測,相比于傳統的免疫診斷方式,具有不可替代的優勢,基于 PCR 技術的分子診斷是醫院對傳染病診斷的“金標準”。PCR 經過三代技術更迭,精確度和靈敏度不斷提高。PCR 技術最早由穆勒于 1985 年發明,經歷了第一代定性 PCR、 第二代定量 PCR 和數字 PCR 三代技術迭代,其中第二代定量 PCR 包括熒光定量 PCR(qPCR)以及在其基礎上分 化出來的 ARMS(突變擴增阻滯系統)和 HRM(高分辨溶解曲線)。三代技術的主要差異如下:
第一代定性 PCR 技術:采用瓊脂糖凝膠電泳對 PCR 擴增產物進行分析,存在交叉污染、檢測耗時長、只能做 定性檢測等缺點,目前處于衰退期,已基本被淘汰;
第二代熒光定量 PCR(qPCR)技術:qPCR 在一代定量 PCR 的基礎上引入熒光探針標記法從而實現定量檢測,目前發展最成熟、應用最廣泛、臨床普及率高,為現階段主流應用平臺,正處于從成長期向成熟期過渡的 階段,市場增速在 20%以上;
第三代數字 PCR(dPCR)技術:dPCR 是在 PCR 原理的基礎上利用芯片和熒光檢測技術進行核酸絕對定量 檢測。芯片技術是 dPCR 的核心工藝,利用對樣品進行分液處理進而實現“單分子模板 PCR 擴增”,達到定量 檢測的目的,具有更高的精確度和靈敏度,目前處于導入期,市場增速在 10%-15%。
二代PCR:主流分子診斷平臺,伴隨診斷和感染性疾病領域為主
qPCR(熒光定量PCR)是目前應用最成熟、臨床應用最廣泛的技術平臺。qPCR 在國內外均為分子診斷臨床應用最 廣泛的技術平臺,尤其是在感染性疾病(病毒性肝炎、性病和其他病菌/病毒類等)和腫瘤伴隨診斷領域,目前仍以 qPCR 技術平臺為主。據不完全統計,截至 2020 年 5 月 11 日,國家藥監局共批準了 806 個 PCR 類產品,其中熒光定量 PCR(qPCR)產品占比高達 85.11%。在伴隨診斷領域,NMPA 獲批的伴隨診斷產品中有 60%都是基于 qPCR技術,而 FDA 批準的 39 個伴隨診斷產品基于 qPCR 技術的產品占比也高達 38.46%(15 個)。
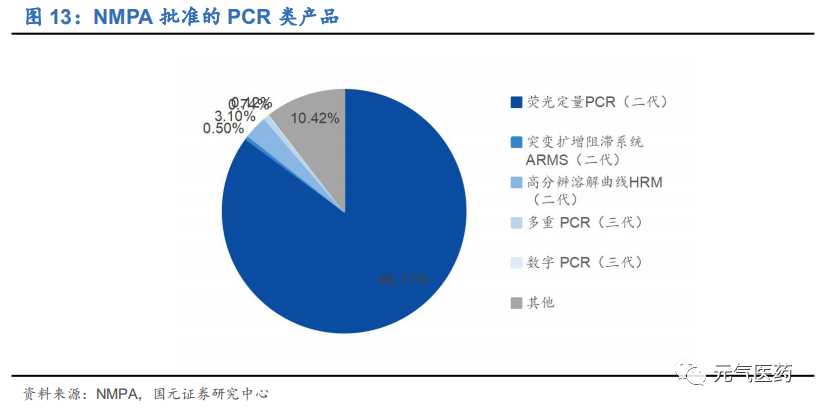
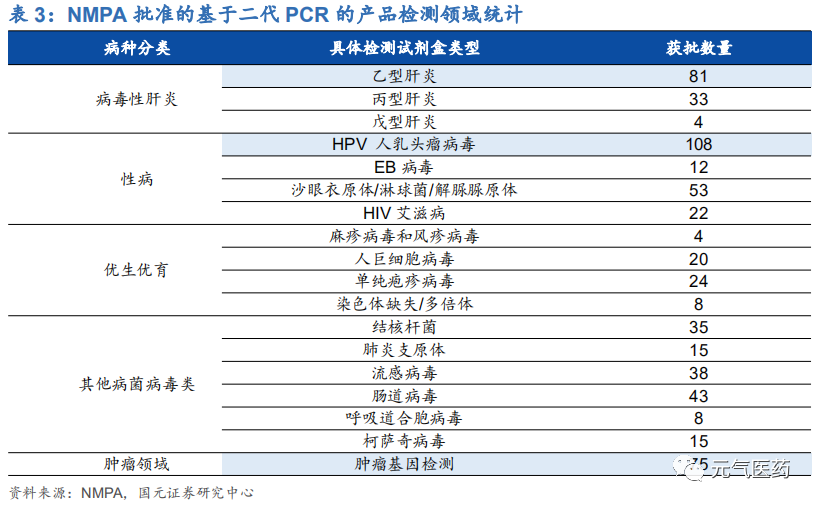
國內 PCR 行業競爭激烈,不同細分領域龍頭效應顯著。二代 PCR 技術門檻相對較低,國內獲批的 PCR 檢測產品數量多、競爭激烈,主要企業包括達安基因、艾德生物、凱普生物、之江生物、碩世生物、透景生物、圣湘生物等。從獲批的 PCR 檢測試劑盒數量維度看,達安基因擁有 38 種基于 qPCR 技術的檢測試劑盒取得 NMPA 的批文;從不同細分應用領域維度看,各家產品線重合度較高,尤其是優生優育、性傳播疾病、HPV 檢測等領域競爭激烈,但艾德生物、凱普生物、亞能生物憑借多年在不同細分領域的先發優勢、技術積累以及渠道優勢等分別在伴隨診斷、HPV 檢測、地中海貧血檢測領域處于絕對領先地位,其中凱普生物在 HPV 檢測領域占據 1/3 市場份額,艾德生物在 PCR 伴隨診斷領域具有絕對領先優勢。
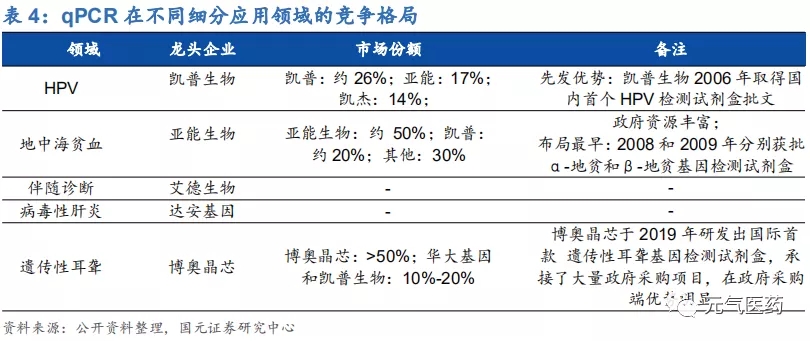
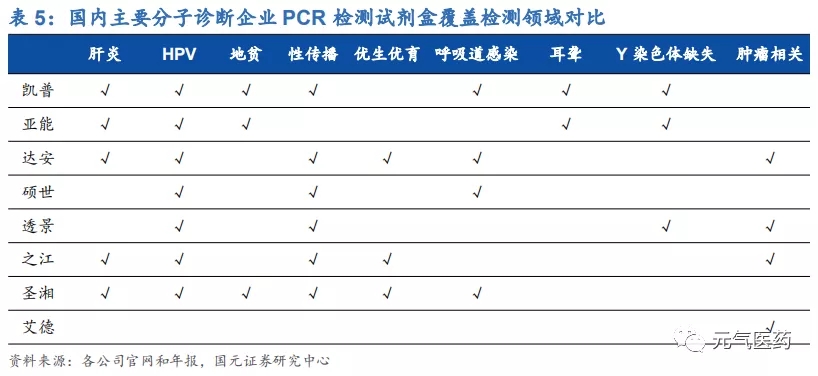
第三代數字 PCR(dPCR):應用前景廣闊,未來發展趨勢
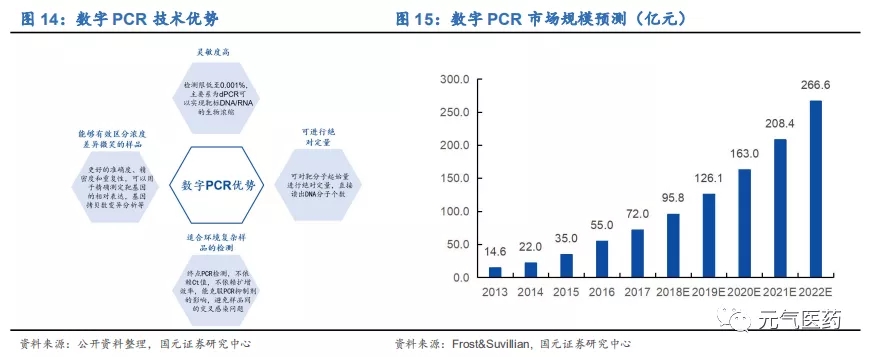
和 qPCR 相比,dPCR 優勢包括:靈敏度高(可以達到單個核酸分子)、無需標準曲線或參照基因進行對比來測量核 酸量、適合環境復雜樣品的檢測、能夠有效區分濃度差異微小的樣品。dPCR 在國內尚處于起步階段,目前僅有南京科維思生物的 HER2 基因擴增檢測試劑盒(數字 PCR 法)獲批,在腫瘤伴隨診斷、腫瘤早篩、傳染病檢測、NIPT、 藥物基因組學等領域具有較大臨床應用潛力和優勢。根據沙利文數據顯示,中國 dPCR 行業市場規模從 2013 年的 14.6 億元增加至 2017 年的 72 億元,CAGR=29.2%,到 2022 年市場規模預計將達到 266.6 億元。
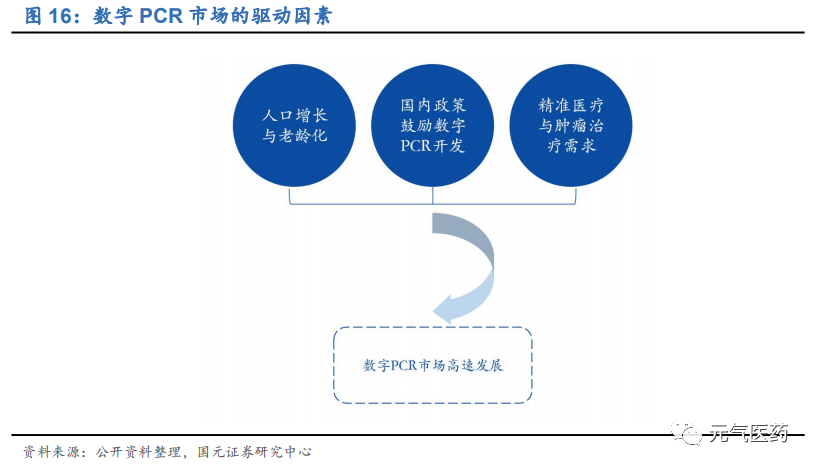
國內政策利好+精準醫療需求雙輪驅動數字 PCR 快速發展。數字 PCR 領域未來發展潛力巨大,主要驅動因素包括:
人口增長與老齡化:我國人口老齡化趨勢導致腫瘤醫藥市場增長和體外檢測需求增長,而數字PCR在腫瘤檢測、傳染病檢測、遺傳病等疾病檢測上優勢明顯,醫療市場的擴容將進一步推動數字PCR的增長。
國內政策利好:根據國家科技部辦公廳發布的《“十三五”醫療器械科技創新專項規劃》,要求重點開發POCT檢測、新型基因測序儀、隨檢全自動核酸檢測系統、定量數字PCR等系統;
精準醫療與腫瘤治療需求:精準醫療的基礎在于個體化醫療,對致病突變檢測和定量分析的精確性要求較高, 亟需新一代PCR技術的應用,而數字PCR在這方面優勢明顯。
PCR 技術更迭速度快,從傳統的普通 PCR 到新興的數字 PCR,靈敏度不斷提升。作為國內應用最為廣泛的分子診 斷技術平臺,PCR 具有靈敏度高、特異性好、使用方便等優點,廣泛應用于感染性疾病病原體檢測、腫瘤基因檢測、 血篩、遺傳病檢測等領域,占分子診斷市場規模的比例超過 30%。第二代熒光定量 PCR 是目前 PCR 技術的主流, 第三代數字 PCR 是未來發展方向,應用前景廣闊。國內達安基因、艾德生物、凱普生物等是 PCR 技術領域的龍頭 企業,在傳染病、HPV、伴隨診斷等不同細分領域擁有絕對的競爭優勢。
1.3 高通量測序(NGS):引領分子診斷走向高端,應用前景廣闊
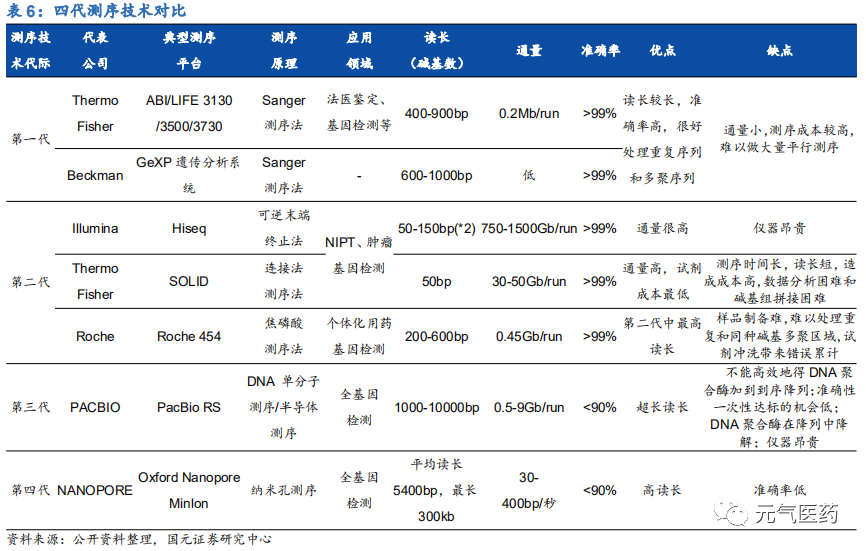
測序技術更迭速度快,二代高通量測序(NGS)為市場商用主流。從 1977 年第一代 DNA 測序技術(Sanger 法)發展至今,測序技術經歷了第二代高通量測序(NGS)、第三代單分子測序技術和第四代納米孔測序技術的發展變 革,各代技術應用領域不盡相同,各有優缺點,目前處于三代技術并存的局面。第一代 Sanger 測序技術具有測序讀長較長、準確率高的優點,但由于通量低、成本高等因素沒有得到大規模應用;二代測序技術自 2005 年以來快速發展,憑借高通量、低成本、測序時間端等優勢,在全球測序市場中仍占據主導地位;第三/四代技術在測序流程、測序時間和讀長上進一步優化,在 ctDNA 測序、單細胞測序等也具有明顯優勢,是未來發展趨勢,但目前由于錯誤率較高、分析軟件不夠豐富等原因,商用受到一定限制,未來隨著技術的改善有望進入成熟應用階段。
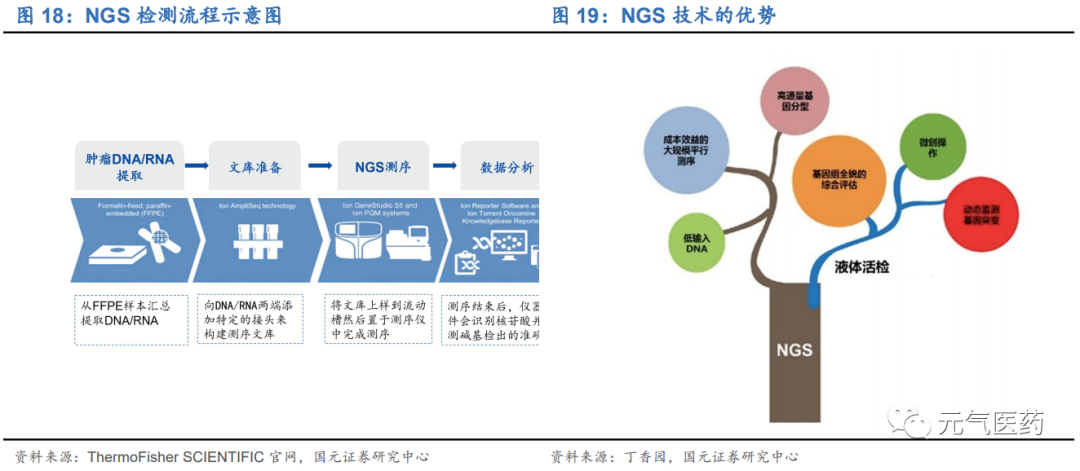
高通量測序技術(NGS)又稱為下一代測序技術,是指通過模板DNA 分子的化學修飾,將其錨定在納米孔或微載體芯片上,利用堿基互補配對原理,在 DNA 聚合酶鏈反應或 DNA 連接酶反應過程中,通過采集熒光標記信號或化學反應信號,實現堿基序列的解讀,一次性可完成幾十萬至上百萬條序列的測定。NGS技術可提供滿足評估目標 靶向基因所需的擴展性、速度和分辨率。可以同時對許多樣本中的多個基因進行評估,如此便可運行多個獨立的分析,從而節省時間并降低成本。另外,與范圍更廣的方法(如全基因組測序)相比,靶向基因測序生成的數據量更少,更易管理,因而分析起來更加輕松。
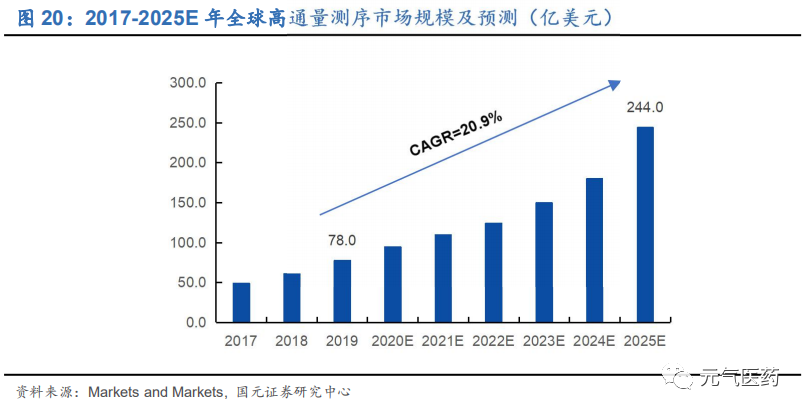
多因素驅動 NGS 市場高速發展。隨著 NGS 技術進步和測序成本的降低、腫瘤醫生和病人對 NGS 檢測認知不斷完善、測序服務對象和應用細分領域的拓展、企業間合作的增加,NGS 有望迎來快速發展。根據美國Markets and Markets 報告顯示,預計全球高通量基因測序市場規模將從 2019 年的 78 億美元增加至 2025 年的 244 億美元, CAGR 為 20.9%。
NGS 在 NIPT 領域應用最成熟,腫瘤早篩、個體化用藥等前景廣闊。與其他分子診斷技術相比,NGS 技術具有通量高、準確度高、可以多重檢測、所需樣本量少等優點,在醫學研究及臨床檢測中得到廣泛應用和推廣,主要包括無創產前檢測(NIPT)、胚胎植入前遺傳學診斷/篩查(PGD/PGS)、遺傳病診斷、腫瘤診斷和個性化治療、致病基因檢測、病原微生物檢測等:
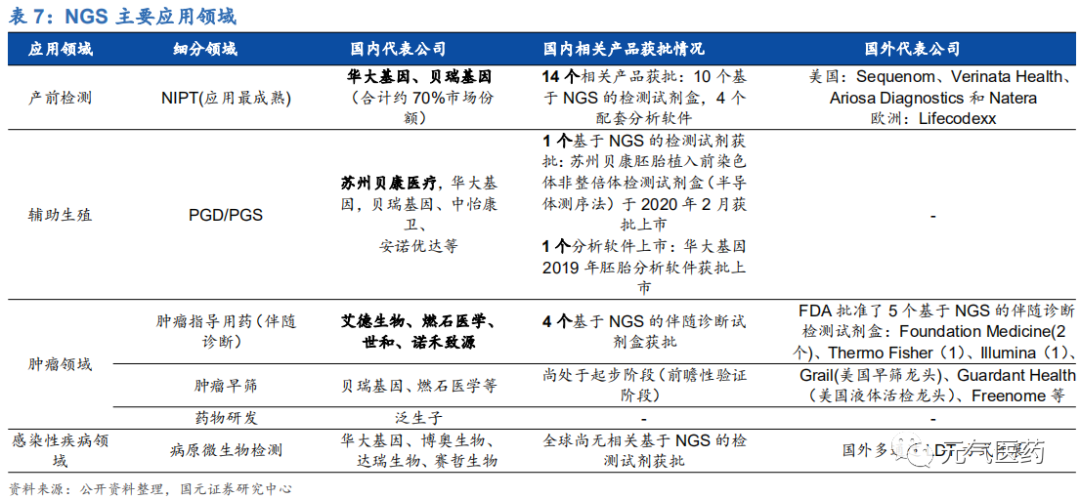
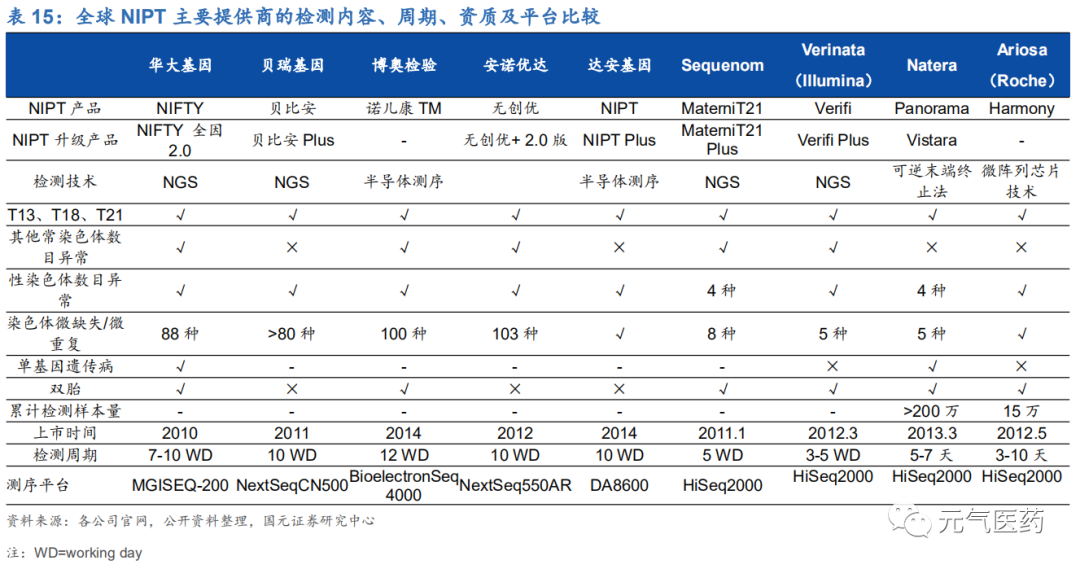
(1) 無創產前檢測(NIPT):是 NGS 臨床應用最為成熟的領域,國內 NIPT 檢測價格大多在 800-2400 元之間,深圳、天津等地區已經將 NIPT 納入醫保,未來隨著價格不斷降低以及對 NIPT 認知度提升,滲透率或穩 步上升。國內目前共 10 個基于 NGS 的 NIPT 檢測試劑盒獲批上市,其中華大基因和貝瑞基因先發優勢 明顯,占據 70%的市場份額,形成雙寡頭競爭格局。國外代表公司包括美國Sequenom、Natera、Verinata 和 Ariosa 以及歐洲的 LifeCodexx。
(2) 胚胎植入前遺傳學診斷/篩查(PGD/PGS):PGD/PGS 是指在輔助生殖過程中,對胚胎進行種植前的活檢和 遺傳學分析,以選擇無遺傳學疾病的胚胎植入子宮。相比傳統的 FISH 和 PCR 技術,NGS 最大的優點在 于它不僅可以檢測胚胎的非整倍體,還能檢測單基因遺傳疾病,目前該領域仍處于探索階段,國內僅有蘇州貝康的胚胎植入前染色體非整倍體檢測試劑盒(半導體測序法)于 2020 年 2 月獲批上市,另外華大基因、中儀康衛、貝瑞基因、安諾優達等也在積極推進其胚胎植入前檢測產品的上市。PDG/PGS 在輔助生殖領域的應用價值越來越明顯,未來隨著測序成本降低和更多產品獲批,市場需求有望持續擴大,或成為 繼 NIPT 之后 NGS 在生育健康領域新的“藍海”市場。
(3) 腫瘤領域:伴隨診斷、腫瘤早篩和藥物研發是 NGS 檢測在腫瘤領域應用的三大場景,其中伴隨診斷是當前腫 瘤 NGS 檢測最主要的應用領域(超過 95%),2018 年燃石醫學拿到“國內腫瘤 NGS 檢測試劑盒第一證”,此后艾德生物、世和基因和諾禾致源的腫瘤 NGS 檢測試劑盒相繼獲批。根據灼識咨詢報告顯示,在中國 NGS 癌癥治療方案提供商市場的醫院細分市場中,按檢測患者人數計,燃石醫學 2019 年市場份額達到 79.9%,先發優勢明顯。在腫瘤早篩領域,目前主流技術液體活檢仍存在一定局限性。(4) 感染性疾病病原體檢測:在病原微生物檢測方面, NGS 檢測具有獨特的優勢,不受限于傳統 PCR 技術需要 利用已知物種的 DNA 序列設計 PCR 引物探針,可實現對未知的疾病相關的微生物快速鑒定,目前已經成功應用于 H1N1 病毒基因組的發現和結核桿菌分子分型等。但目前 NGS 在微生物領域應用仍處于方法學的標準品驗證階段,全球尚無該領域的檢測試劑盒獲批,應用前景值得期待。
1.4 不同技術平臺應用場景重疊度較低,多種方法或長期共存
分子診斷技術應用場景多樣化,不同技術各有優勢。在實際應用中,針對每種特定的應用場景,往往需要綜合考慮患者治療過程、不同癌癥的采樣方式和病例組織形態、患者身體狀況和經濟水平等因素來決定使用哪種診斷手段。不同平臺各有優勢,未來 3-5 年呈現長期共存、相輔相成的局勢,以不同突變基因和突變類型為例:(1) HER2 擴增或過表達:對 HER2 基因表達的檢測辦法可以采用 FISH、IHC、CISH 等,一般來說,實驗室首先 采用 IHC 方法進行 HER2 蛋白檢測,如果檢測結果為 2+,則使用 FISH 技術進行 HER2 基因檢測確認;(2) 染色體片段微缺失微重復(CNV):基因芯片技術對片段微缺失微重復(CNV)具有較好的檢驗結果,而目前測序較難對 CNV 進行準確的檢測;(3) ALK 基因擴增和 ROS1 基因融合:FISH 是目前使用的主流技術。
一些特定基因檢測往往需要結合多個診斷手段,提高檢測準確率。以 ALK 基因檢測為例,根據《中國非小細胞肺癌 ALK 檢測臨床實踐專家共識》,Ventana-D5F3 IHC、FISH、RT-PCR、NGS 四種技術均可用于 ALK 基因融合檢測, 但沒有一種方法可以保證 100%準確率,在檢測時需要根據具體情況結合多個技術以避免出現漏檢、錯檢的問題。

NGS 近些年發展迅速、異軍突起,廣闊的市場應用前景吸引大量企業爭相入局,疊加資本市場季度青睞,NGS 迎來 井噴式發展,市場普遍認為 NGS 終將會取代以 PCR 為主導的傳統分子診斷技術平臺,企業布局 NGS 一定比 PCR 更具有未來。但根據我們的觀察和分析,我們認為 PCR 技術和 NGS 技術優勢互補,分別滿足不同場景的臨床檢測需求,將在相當長的一段時間內優勢互補、共同發展。
1.5 產業鏈上游儀器端受外資把控,試劑和服務端國產多點開花
分子診斷產業鏈由上游的設備和試劑、中游的基因測序服務、下游的醫院等需求終端組成:
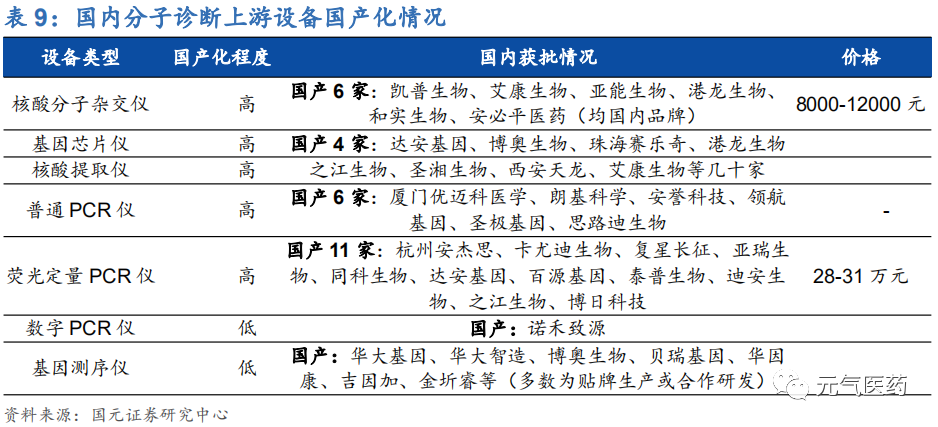
上游診斷試劑和儀器供應商:國內分子診斷試劑發展較為迅速,基本已經實現國產化;診斷儀器領域,國產儀 器占比較小,其中核酸提取儀、普通 PCR 儀、基因芯片儀、分子雜交儀等技術相對容易攻破的中端儀器領域 基本已經實現國產替代化,而包括數字 PCR 儀和基因測序儀在內的高端儀器主要由外資品牌主導,技術壁壘 極高,國產品牌正處于起步階段。數字 PCR 儀目前市場上基本被 Bio-Rad、Thermo Fisher、Stilla Technomogies 國際大品牌所占有。基因測序儀領域基本被 Illumina、Thermo Fisher、Rocher 等外資品牌 壟斷,目前國內僅有華大基因等個別優秀國產品牌實現了自主研發生產的基因測序儀,大多數企業是通過 OEM (貼牌)和合作研發的形式完善產業鏈布局。
中游測序服務供應商:國內基因測序服務競爭激烈,企業眾多。國內基因測序服務提供商普遍對上游儀器和試 劑供應商依賴嚴重,絕大部分廠商不具備自主研發基因測序儀和和核心試劑的能力,議價能力弱。華大基因從 基因測序服務為切入口,目前已經發展成全球最大的基因測序機構,同時還擁有自主研發的基因測序儀,是國 內為數不多的布局基因測序上中下游產業鏈的企業之一。
下游需求市場:分子診斷產業鏈下游是為患者提供醫療服務的機構,包括醫院、第三方醫學檢驗服務機構、科 研機構、藥企等。與發達國家相比,我國獨立實驗室發展較晚,市場規模小,占醫學診斷市場比例低,其中檢 測項目以普檢為主,高端檢測比例低。

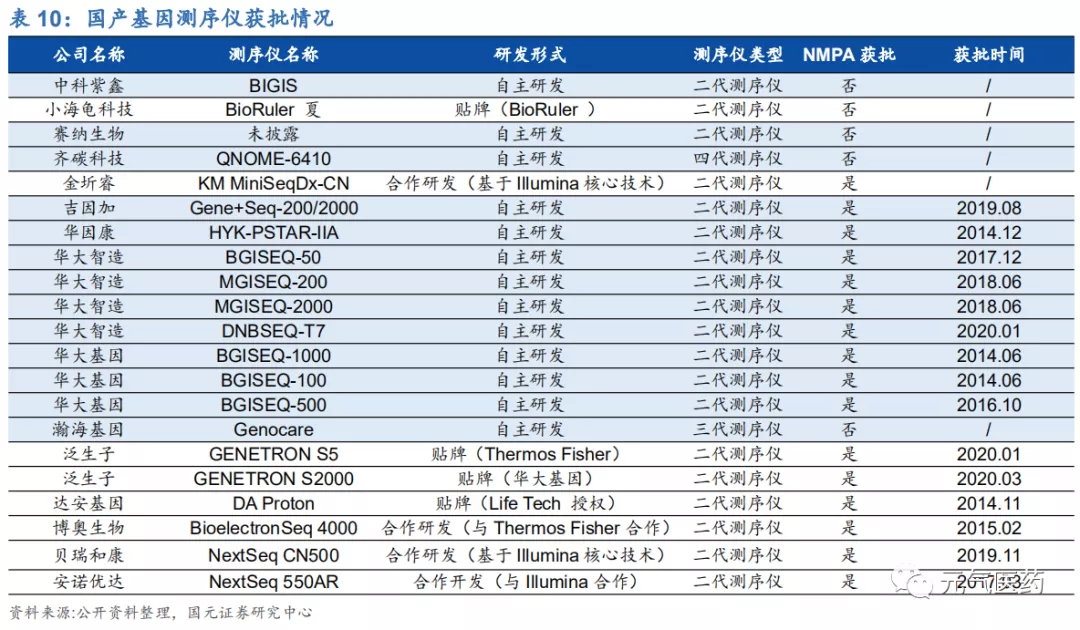
NGS 測序儀由外資品牌主導,國產品牌逐漸發力。測序設備生產商是整個 NGS 產業價值鏈的上游部分,技術壁壘 較高,從全球范圍看目前被 Illumina、LifeTech、Roche 等少數幾家廠商壟斷,呈現典型的寡頭壟斷競爭格局。根 據前瞻產業研究院數據顯示,2018 年 Illumina 占據全球二代基因測序儀 84%的市場份額,LifeTech(2013 年被賽 默飛收購)和 Roche 合計占據 15.2%,其他廠商不到 1%。在國內市場,鑒于成本和技術難度等問題,進行測序研 發設備的企業數量較少,近年來,國內以華大智造(和華大基因是兄弟公司,測序儀主要供應商)為首的基因測序儀制造商逐漸興起,并占據一定的市場份額,但由于發展時間短,國產測序儀在測序讀長和測序穩定性方面仍有待提高。
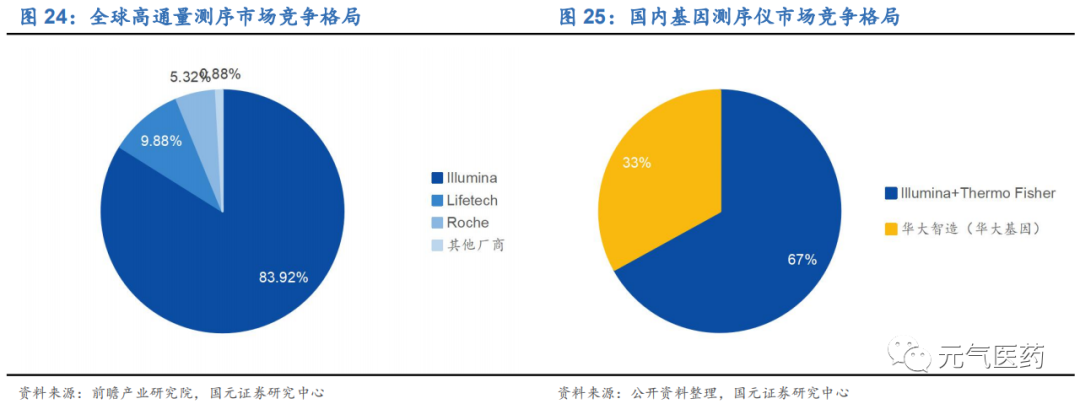
華大基因成國產品牌翹楚,測序儀全球裝機量領先。目前獲 NMPA 批準上市的測序儀中,國產品牌中一半都是來自華大基因(包括其參股公司華大智造),其他二代測序儀大多數是通過海外產品的 OEM(貼牌)或者基于海外企業 的核心技術進行合作研發,產品價格還是受到國外企業的控制,比如達安基因的 DA Proton、貝瑞和康的 NextSeqCN500、安諾優達的 NextSeq550AR 等產品走的都是貼牌路線。從市占率看,Illumina(全球裝機 1.1 萬 臺)和賽默飛在國內市占率約 67%,華大智造國內市占率約 33%(全球裝機 1100 臺),其它國產測序儀未量產投放。
國內 NGS 發展受制于檢測費用過高,國產化替代是關鍵。目前 NGS 在在腫瘤檢測領域的應用受制于費用過高,根 據思略特研究數據,2017 年國內腫瘤 NGS 基因檢測平均單次費用為 7500 元,遠高于 NIPT 檢測的 1000-2000 元 /次,這主要是由于上游測序儀仍由進口品牌壟斷,進口品牌擁有較高的話語權和定價權。華大智造雖然有潛力實現在測序儀領域的“突圍”,但仍需要經歷一段較長的市場培育期,而對于大多數不具有測序儀自主研發實力的本土 企業來說,需要更多來打破進口品牌的寡頭壟斷。只有當國產品牌在上游儀器端全面實現突破并掌握話語權,NGS 檢測成本才能不斷降低、可及性才能逐步提升,從而加快在國內醫院端的落地。
1.6 小結:PCR 和 NGS 優勢互補,儀器端國產替代空間大
國內分子診斷行業起步晚但技術起點較高,目前市場規模基數較小,是近幾年增速最快的體外診斷領域,在新技術 發展迅猛、應用領域持續拓寬、國產替代進程加速等驅動下,未來 3-5 年有望維持 30-50%的高速增長。根據智研咨詢報告顯示,預測 2025 年國內分子診斷市場規模將達到 260 億元,未來前景可期。
從不同技術平臺看,一方面,PCR 仍將是被市場認可、應用成熟的主流分子斷技術平臺,液體活檢、數字 PCR、NGS 等新興技術的快速發展將進一步豐富分子診斷的應用領域,作為未來進入臨床轉暖的儲備力量,潛力十足;另一方面,鑒于分子診斷復雜的應用場景、各類患者多樣化的臨床需求,新技術的出現不是為了完全取代傳統技術,而是 更好的補充和完善現有技術平臺,比如 PCR 技術經過幾十年的發展也沒有完全淘汰 FISH 技術,后者仍是檢測 HER-2 基因狀態的“金標準”;根據應用場景和檢測需求的不同,NGS 和 PCR 上各有優勢,PCR 適合基因位點已知、對靈敏度要求較高以及組織樣本的檢測,NGS 在發現未知基因、血液 ctDNA 檢測上則更具優勢,二者是優勢互補、長期共存的關系。
從國產替代進程看,目前國內在產業鏈上游的測序儀開發商仍處于弱勢競爭地位,雖然華大基因和貝瑞基因擁有自主研發生產的二代測序儀,但大多數企業還是通過貼牌貨合作的方式引用進口 PCR 和基因測序儀,議價能力弱。
分子診斷尤其是 NGS 的發展很大程度上將依賴于上游設備的國產替代進程。預計隨著政策鼓勵以及更多優秀企業向上 游儀器端布局,國產替代進程有望進一步加速。血液篩查等,以及目前處于萌芽期或快速發展期的腫瘤早篩、新型微生物檢測、藥物基因組學等。我們將在下文重點剖析和對比 NIPT、伴隨診斷、腫瘤早篩、傳染病檢測和消費級基因檢測 5 個細分應用場景以及特定場景下不同技術的使用現狀和發展趨勢。
2.分子診斷應用領域
2.1 無創產前檢測(NIPT):市場廣闊而成熟,滲透率仍有提升空間
相比傳統血清學唐篩,NIPT 擴大檢測時間窗口,安全性、特異性、敏感性大幅提高。孕婦產前篩查和產前診斷不同, 前者的目的是在健康人群中篩查出高風險孕婦,進而通過羊水穿刺、臍帶血穿刺等侵入性診斷方法進行確診,從而避免 21 三體綜合征等胎兒遺傳病的發生。目前我國臨床上針對染色體非整倍體的篩查手段包括超聲檢查、血清學唐氏篩查和無創產前 DNA 檢測(NIPT),前兩種方法存在較高的假陽性率和漏診率,血清學唐氏篩查作為傳統的產前篩查手段,根據孕周大小分為早期篩查(9-13 周)和中期篩查(15-20 周),早孕期聯合超聲波 NT 的唐篩篩查 染色體異常的檢出率約為 70%-80%,中孕期篩查的檢出率約為 65%-70%,仍存在明顯不足。高特異性的 NIPT 很 好地彌補了這兩種方法的缺陷,已有報道顯示,NIPT 應用于染色體非整倍體異常胎兒檢測的敏感性為 91.7%-100%,特異性為 97.9%-100%。NIPT 檢測時間窗口較寬,適用于孕 12-26 周,早于 12 周孕婦血中胎兒 DNA 含量較低, 可能會導致檢測存在誤差。
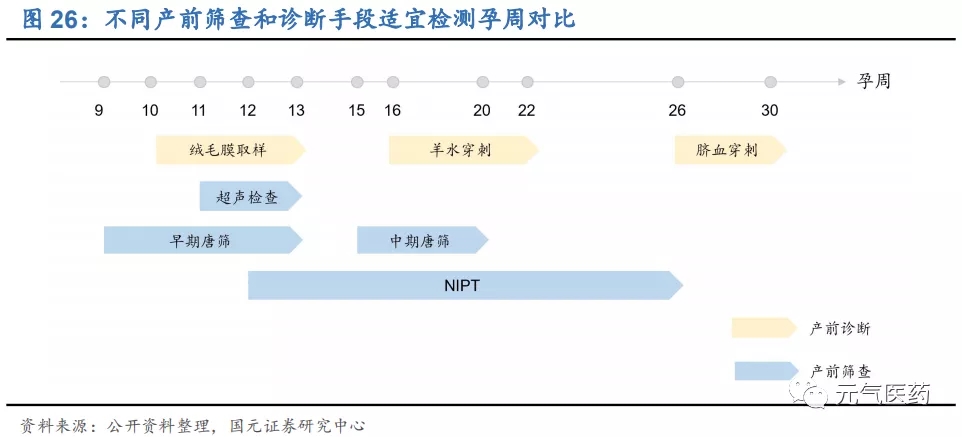
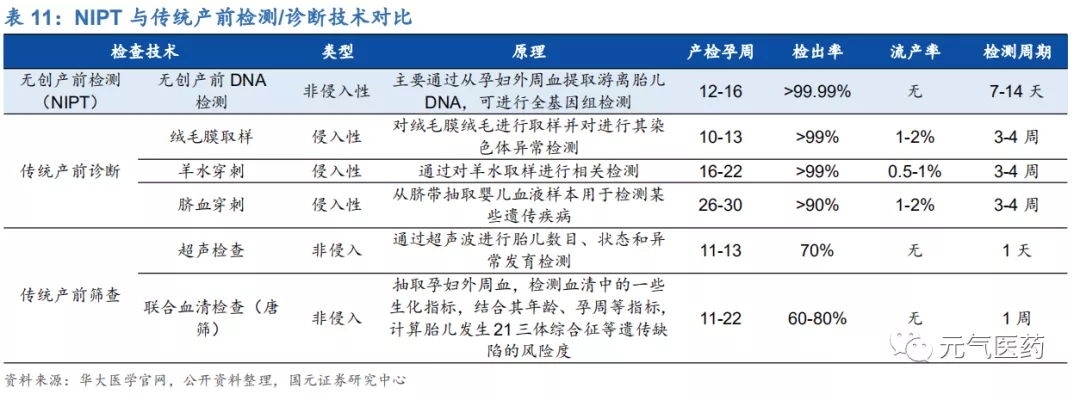
NIPT 以高通量測序(NGS)為主,具有無創、檢出率高、流產風險低等優勢。基于母體外周血胎兒游離 DNA(cfDNA) 和高通量測序(NGS)等技術的無創產前檢測(NIPT)是基因測序在生育健康領域的重要應用,檢測原理是通過采取孕婦靜脈血,利用高通量測序技術(NGS)對母體外周血漿中的游離 DNA 片段(包括胎兒游離 DNA)進行測序, 并將測序結果進行生物信息分析、從中得到胎兒的遺傳信息,從而檢測胎兒是否有染色體異常的疾病,主要用于 3 種染色體數目異常遺傳疾病:21 三體綜合征(唐氏綜合征)、18 三體綜合征(愛德華氏綜合征)、13 三體綜合征 (帕陶綜合征)。NIPT 具有無創、檢出率高、漏診率低、檢測周期短、流產風險低、操作簡便等多方面優勢:(1) NIPT 只需抽取 5-10ml 母體靜脈血,屬于非侵入式檢查,從而避免了流產風險和宮內感染的可能性;(2)基于 NGS 的 NIPT 檢測準確率較高,其中對于 21 三體綜合征的檢出率達到 99%以上,且懷孕 12 周即可接受 NIPT,能夠盡 早發現問題、及早預防。
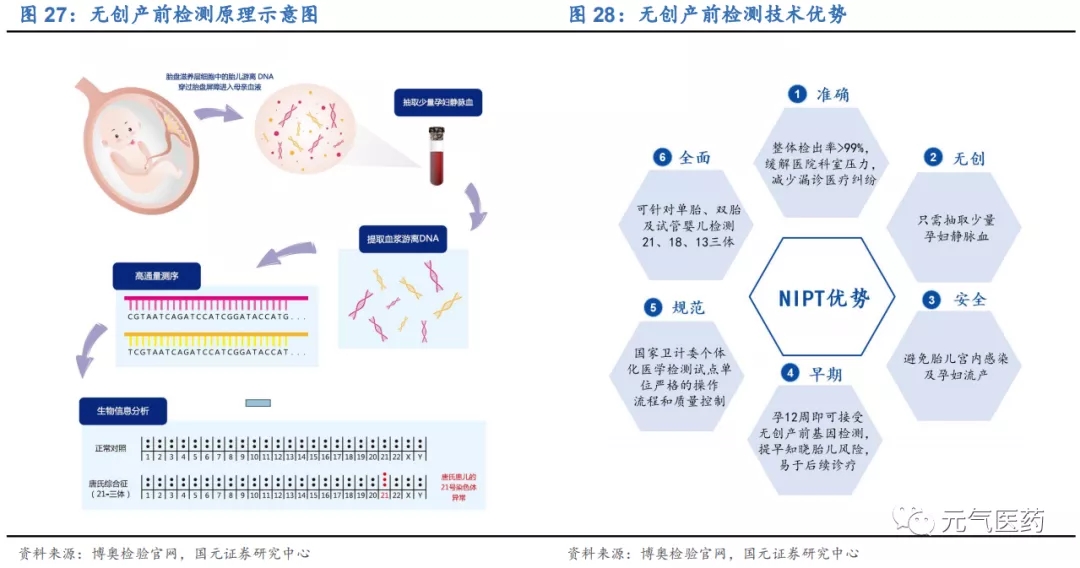
技術不斷升級,NIPT Plus 拓寬檢測領域。NIPT 可以分為基礎版(NIPT)和升級版(NIPT Plus),基礎版 NIPT 只 能檢測出 13、18 和 21 號染色體非整倍體異常,而 NIPT Plus 將檢測范圍拓展至染色體微缺失/微重復綜合征、性 染色體異常、其他常染色體異常等。國內華大基因和貝瑞基因均開發出 NIPT Plus 系列產品,其中貝瑞基因的貝比安 Plus®將篩查疾病種類由 3 種擴展至百余種,檢出率提高 1 倍,預計 2020 年內申報注冊;華大基因 2018 年 10 月推出的升級版 NIFTY®全因 2.0 產品在全部染色體非整倍體、88 種明確的染色體缺失/重復綜合征的檢測基礎上, 新增軟骨發育不全單基因遺傳病檢測,彌補了國內 NIPT 在單基因疾病檢測應用領域的空白。雖然政策上目前只有 13、18 和 21 三體是臨床批準的檢測項目,但隨著升級產品的研發逐步成熟以及預防遺傳病的有效性逐步得到臨床 認可,NIPT 滲透率有望加速提升。

2.1.1 全球市場:各國積極推廣 NIPT,有望納入常規產前篩查
經過多年發展,NIPT 的安全性和有效性已經得到各國專業協會和機構的驗證和認可,應用相對成熟,商業化程度較高。2015 年《新英格蘭醫學雜志》表明 NIPT 也能適用于常規普通人群,檢出率比傳統篩查方法高,且假陽性率較低;2018 年美國醫學遺傳和基因組學會(ACMG)發表聲明,NIPT 目前最敏感的 21、18 和 13 三體綜合征產前篩查技術,可以在不同年齡人群中替代傳統的染色體非整倍體綜合篩查方法,未來 NIPT 市場覆蓋人群有望從高風險孕 婦延伸至一般孕婦群體。
各國政府對 NIPT 檢測實施鼓勵措施,推動 NIPT 滲透率提升。目前,NIPT 檢測技術已經在全球 90 多個國家陸續開展,歐美國家商業化程度較高,據統計,2012-2014 年全球范圍內 NIPT 檢測樣本量分別為 20 萬、40 萬和 80 萬,截至 2015 年底已經超過 200 萬例。在美國,NIPT 市場主要被 Sequenom、Verinata Health、Ariosa Diagnostics 和 Natera 四家公司覆蓋,高風險孕婦(比如唐篩風險率在 1/270-1/1000 的孕婦)主要是個人自費或個人+保險公 司共同承擔的模式,中低風險孕婦的 NIPT 篩查還沒有保險公司承保。歐洲 NIPT 市場由德國 LifeCodexx 一家公司 獨占,自費為主。此外,英國、德國、荷蘭等國家也出臺相關政策積極推動 NIPT 的推廣和應用。

2.1.2 國內監管政策趨嚴,NIPT 逐步走向成熟
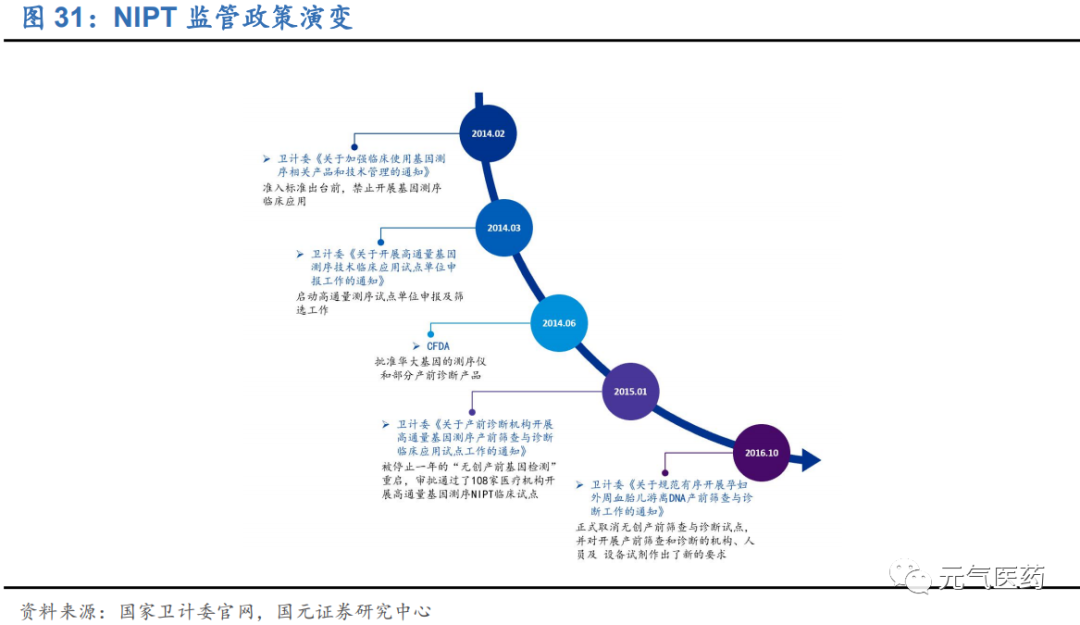
NIPT 技術及其相關產品涉及倫理、隱私和人類遺傳資源保護、價格、質量監管等問題,因此政府的政策監管尤為重 要。作為一項新興的檢測技術,NIPT 在國內的政策監管經歷了自由發展、監管嚴格、試點準入、分業監管等階段:
2014 年以前:基因測序行業尚處于無監管狀態
2014 年 2 月:CFDA 開始對 NIPT 行業嚴格監管,明確所有進行 NIPT 的儀器和試劑必須要經過 CFDA 認證 后才能使用
自 2014 年 6 月起:CFDA 先后批準了華大基因、達安基因、博奧生物、貝瑞基因等多家公司的無創產前檢測產品,NIPT 監管逐步規范化,108 家醫療機構成為無創產前檢測的臨床試點。2016 年 10 月衛計委發布《國家衛生計生委辦公廳關于規范有序開展孕婦外周血胎兒游離 DNA 產前篩查與診斷工作的通知》,NIPT 試點 政策正式結束,標志著 NIPT 成為體外診斷的臨床正規部隊。
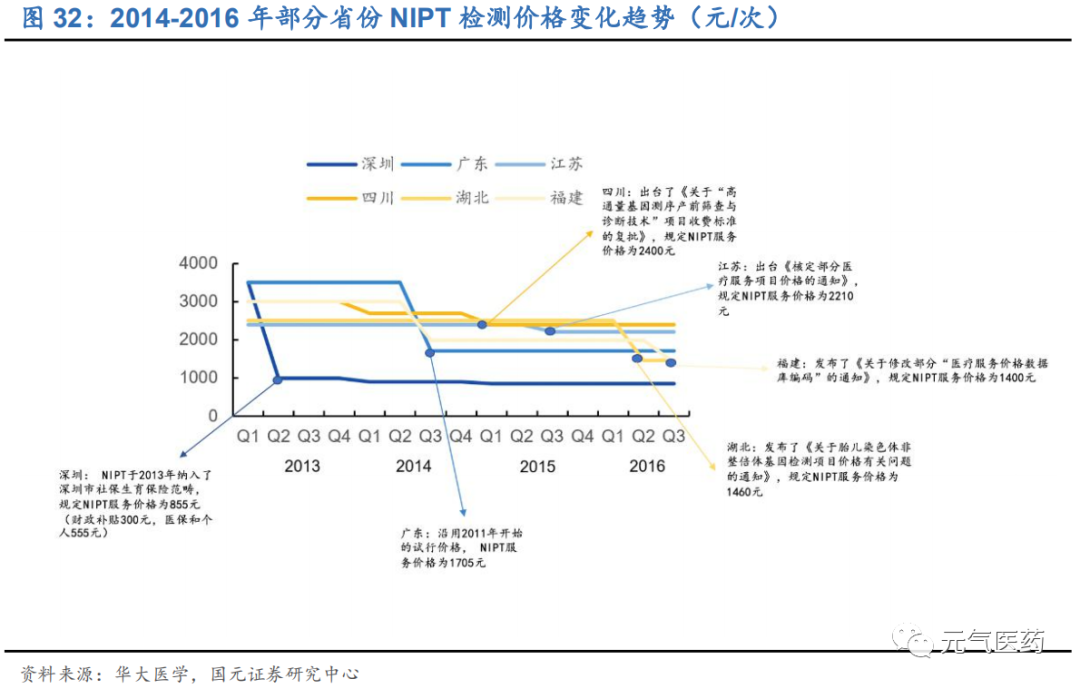
各省市鼓勵全面推廣無創產前篩查,NIPT 進入大眾價時代。2014 年國家叫停了 NIPT 臨床應用后,隨著行業逐步規范化以及測序成本不斷降低,行業競爭日益激烈,NIPT 檢測價格持續下降,同時自 2015 年起多個省市也出臺了 相關政策鼓勵全面推廣 NIPT 并將其納入醫保范疇內,部分省份已經發文明確 NIPT 檢測價格并積極將其納入醫保報 銷范疇,目前各地價格大致在 800-2400 元之間,其中深圳市積極響應號召,率先于 2013 年將 NIPT 納入醫保范疇, 檢測費用僅 855 元/次(其中財政補貼 300 元,醫保和個人 555 元),長沙、武漢、河北等地提供免費 NIPT 檢測服務,而目前香港的 NIPT 檢測單價高達 6000 元左右。NIPT 作為預防新生兒染色體疾病最有效的手段,在政府推廣與醫保補貼下或將迎來快速的市場放量,隨著政策推廣向市縣級的逐步下沉,市場滲透率有望進一步提升。

2.1.3 先發優勢穩固寡頭競爭,市場滲透率仍有提升空間
NIPT 作為首個商業化的臨床測序是產品,市場比較成熟,目前市場上提供 NIPT 檢測服務的廠商有貝瑞基因(貝瑞和康)、華大基因、博奧生物、安諾優達、達安基因等 9 家,其中貝瑞基因和華大基因憑借先發優勢、豐富的臨床數據積累、以及自身技術和平臺優勢,占據絕大部分市場份額,2018 年市占率合計約為 70%。華大基因和貝瑞基因深耕 NIPT 領域多年,憑借先發優勢和技術平臺優勢形成雙寡頭格局:
(1) 先發優勢:貝瑞基因是全球率先研發并成功在臨床推廣無創產前基因檢測技術(NIPT)的公司,2010-2011 年先后開展了國際上最早最全面的 NIPT 回顧性臨床試驗和二期大規模前瞻性臨床試驗,旗下 NIPT 檢測 項目“貝比安”于 2011 年上市,成為全球首個提供 NIPT 檢測服務的供應商,此后公司憑借品牌影響力在 2 年內進入國內 30 多個省份的 150 家醫院,2015 年國家開放試點機構后,公司與全國 108 家試點機構 中的 62 家公立醫院簽訂合作協議,產品服務體系覆蓋起全國 70%的醫學高通量測序實驗室,建立起 NIPT 領域的護城河。根據藥監局要求,NIPT 產品上市之后需要繼續搜集至少 10 家臨床機構、總數不少于 10 萬例臨床使用數據作為臨床補充資料在產品下一次延續注冊時提交,所有臨床資料均由出具數據各臨床機 構主管部門簽章,2019年貝瑞基因完成10萬例臨床數據驗證后成為國內首例也是目前唯一能通過NMPA 延續注冊申請的廠家,其他首次產品注冊已到期的廠商只能走流程重新注冊,這意味著公司產品已經得到 藥監部門的權威認可,在后續市場競爭中將處于更為優勢的地位。華大基因 2010 完成國內首例 NIPT 臨 床樣本檢測后,2014 年旗下基因測序儀和 NIPT 檢測試劑產品 NIFTY®獲 NMPA 批準上市,憑借自身測 序儀上的研發優勢快速搶占市場份額。截至 2019 年底,華大基因和貝瑞基因 NIPT 累計檢測樣本量分別 達到 600 萬例和 350+萬例,領先于其他廠商。
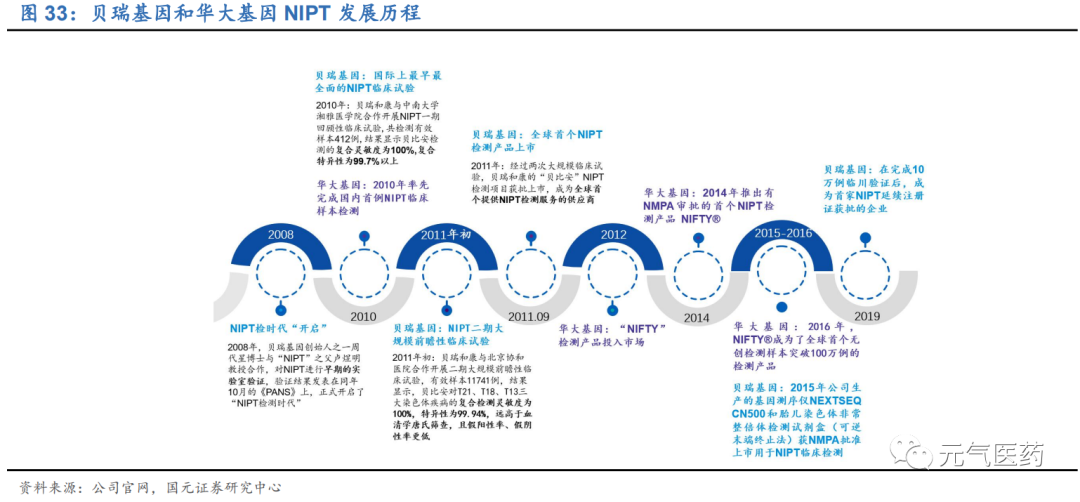
(2) 技術與平臺優勢:華大基因和貝瑞基因擁有豐富的臨床樣本和檢測經驗,構建生育遺傳數據庫與基因組數據庫平 臺,為轉化臨床技術、產品迭代打下基礎。目前兩家公司均已推出 NIPT Plus 升級產品,能檢測更多染色體或基因 遺傳疾病,其中華大基因側重技術迭代,推出的 NIPT Plus 產品檢測染色體種類更加豐富,貝瑞基因側重在已有技 術基礎上不斷完善產品和服務,將檢出率提高了一倍,其 NIPT Plus 產品得到了近 10 萬臨床數據的支撐。未來兩家 頭部企業將憑借自身技術平臺優勢繼續獲得更多市場機會,行業兩強競爭格局將逐漸穩定。從全球 NIPT 檢測產品提 供商的檢測內容看,國內企業在檢測范圍、檢測樣本量上更具優勢。

NIPT “天花板”可見,滲透率提升是關鍵。我國每年新出生嬰兒數基本保持穩定,“天花板”容易達到,因此滲透率提 高將成為 NIPT 市場規模擴大的主要途徑。隨著二胎政策放開、我國 NIPT 市場目前仍處于市場滲透率快速增長的階 段,根據智研智庫調查結果顯示,2015 年我國 NIPT 滲透率只有 4.75%,2016 年上升至約 15%;根據業內一組數 據顯示,2019 年全國 NIPT 檢測樣本量達到 400 萬份,國家統計局公布的當年全國新生兒人數為 1465 萬人,孕婦 的數量在此基礎上會上調 15-20%,約為 1600 萬人左右,據此推算 2019 年我國 NIPT 滲透率為 25%,未來滲透 率的提升空間仍然較大,主要來自以下幾個驅動因素:
二胎政策逐步放開:高齡孕婦占比上升,檢測需求隨之增加;
醫保支付政策的鼓勵:深圳市最早于 2013 年將 NIPT 檢測項目納入社保生育保險范疇,參保人接受 NIPT 檢 測可實現免費(財政補貼 300 元。生育保險支付 555 元);天津市于 2019 年將 NIPT 非整倍體檢測納入醫 保,最高政府指導價格為 1080 元(其中醫保支付 260 元)。未來隨著更多地區(尤其是三四五線城市)對 NIPT 的醫保覆蓋,NIPT 滲透率或將穩步上升;
應用領域由高風險人群向普篩發展的趨勢:目前 NIPT 檢測主要針對高齡孕婦,非高齡孕婦滲透率較低,2016 年約為 3%,隨著大眾健康意識和風險意識的增強,非高齡孕婦 NIPT 滲透率有望增加;
NIPT 檢測范圍擴大:目前 NIPT 檢測仍以 13、18 和 21 號染色體的非整倍體篩查為主,應用領域較為保守, 隨著 NIPT PLUS 等升級產品的推出,未來向其他染色體非整倍體異常、染色體微缺失/微重復、單基因遺傳病 等篩查領域的拓展將極大促進 NIPT 市場的增長。
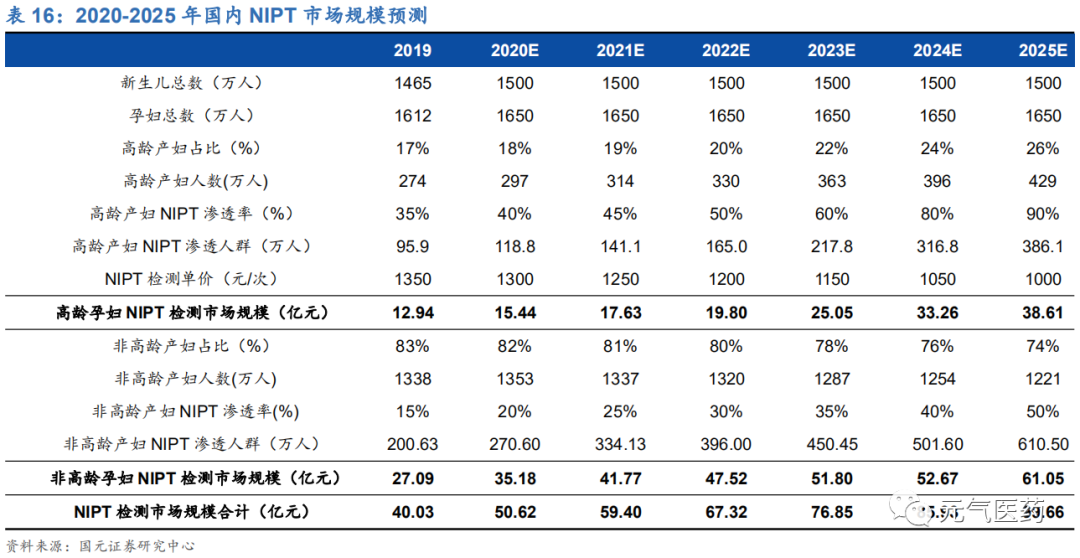
預計 2025 年國內 NIPT 市場規模約為 99.66 億元。對 NIPT 每年市場規模進行測算,假設條件如下:
我國孕婦總數量:根據國家統計局數據顯示,2016-2019 年我國新生兒人數分別為 1846 萬人、1758 萬人、 1523 萬人和 1465 萬人,呈現略微下降趨勢。考慮到育齡婦女人數持續減少以及國內生育意愿較為低迷,我 們預計 2020-2025 年我國新生兒人數分別為 1450 萬人、1430 萬人、1400 萬人、1380 萬人、1350 萬人和 1300 萬人,考慮流產情況等原因,假設孕婦數量在此基礎上上調 10%。
高齡孕婦占比:2016 年我國有 276 萬高齡高危產婦,占比 14.95%,根據 2019 年國家衛健委報告顯示,我 國從 2016 年開始實施全面二孩政策后高齡產婦比例逐年上升,因此我們預計 2020-2025 年我國高齡孕婦占 比分別為 18%、19%、20%、22%、24%、26%。
NIPT 滲透率:2016 年我國高齡孕婦 NIPT 滲透率約 20%,假設高齡孕婦 NIPT 滲透率 2020-2025 年分別為 40%、45%、50%、60%、70%和 80%,非高齡產婦 2020-2025 年 NIPT 滲透率依次為 20%、25%、30%、 35%、40%和 50%。
NIPT 單次檢測價格:目前我國各地區 NIPT 檢測價格大致分布在 800-2400 之間,未來仍有下降趨勢,假設 2020-2025 年平均單次檢測價格分別為 1300 元、1200 元、1100 元、1000 元、800 元和 600 元。
2.1.4 小結:NIPT 呈寡頭壟斷格局,產品升級和醫保覆蓋是核心驅動力
目前 NIPT 應用已經相對成熟,每年新生兒數量保持穩定的趨勢下增量空間有限,但存量滲透率仍有較大提升空間。在監管趨于完善、醫保支付政策鼓勵、孕婦認知度上升等因素推動下,該領域正逐漸走向普及應用階段,滲透率有 望持續上升。市場格局方面,雖然國內 NIPT 檢測產品較為同質化,均能檢測 21、18、13 號染色體非整倍體篩查, 但是華大基因和貝瑞基因憑借先發優勢和豐富的臨床數據積累,占據一二線城市的主流醫院,未來三四線城市將成 為各家競爭的焦點,兩家頭部企業有望在較長時間內繼續保持領先優勢,后進入者很難再有機會改變競爭格局。隨 著測序技術的快速發展,NIPT 產品不斷升級,檢測應用領域持續擴大,尤其是在單基因遺傳病檢測上顯示出強大的 潛力,NIPT 在臨床上的應用前景十分廣闊。
2.2 伴隨診斷:精準醫療的入口,靶向用藥的最佳拍檔
伴隨診斷(Companion Diagnostic, CD)原理是通過在分子靶向藥使用之前檢測病人是否攜帶藥物靶點,實現腫 瘤的個體化治療,提高用藥效率,最終達到用藥最佳療效并減少患者治療費用。從技術層面劃分,伴隨診斷市場可 細分為 PCR(聚合酶鏈式反應)、FISH(熒光原位雜交)、IHC(免疫組化)、NGS(高通量測序)等,其中 PCR、FISH、 NGS 是分子診斷技術的重要組成部分,IHC 屬于免疫診斷方法。
伴隨診斷能夠解決藥物研發風險高、治療應答率低的問題。根 Jorgensen&Hersom 在 2016 年的研究數據顯示,過 去 15 年內批準的靶向藥物中,無伴隨診斷的靶向藥物客觀應答率僅為 7%-45%,有伴隨診斷的藥物客觀應答率 (ORR)在 41%-80%之間,伴隨診斷提升靶向用藥客觀應答率的效果顯著。
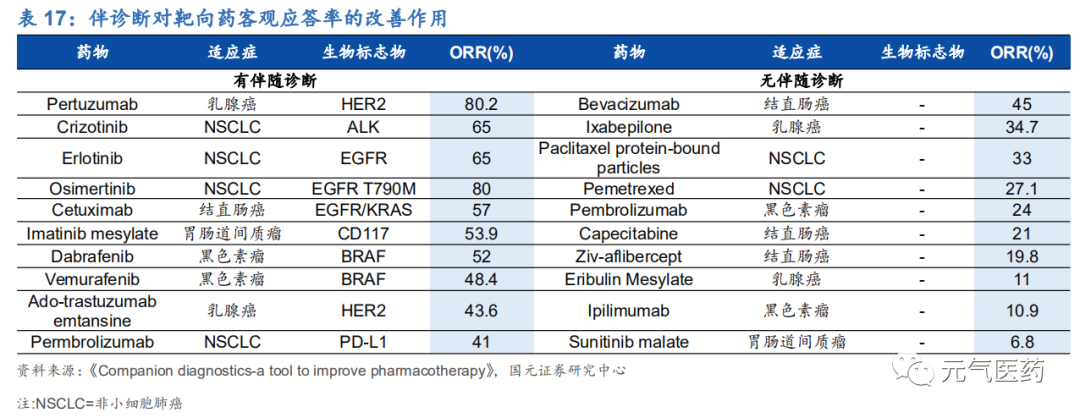
2.2.1 伴隨診斷目前仍以 PCR 技術為主,NGS 增速較快
PCR 實用性強,操作簡便,成本較低,是目前主流伴隨診斷方式。從方法學來說,IHC 主要原理為抗原抗體反應, 顯示結果是基于蛋白層面。其他三種都基于 DNA 層面,而 PCR 技術由于自動化程度高、單位成本低且通過技術開發,在 ddPCR、ARMS-PCR 等精確度更高的方法推出后,實用性強,是最為廣泛使用的診斷方式,但其缺點在于 只能檢測已知突變。而 NGS 技術推出后,也對行業產生巨大影響,它可以一次性檢測出全部突變,并在突變豐度、 罕見突變檢測等方面效果卓越,但由于目前單位成本較高,尚未大規模推行,仍需技術進一步沉淀。
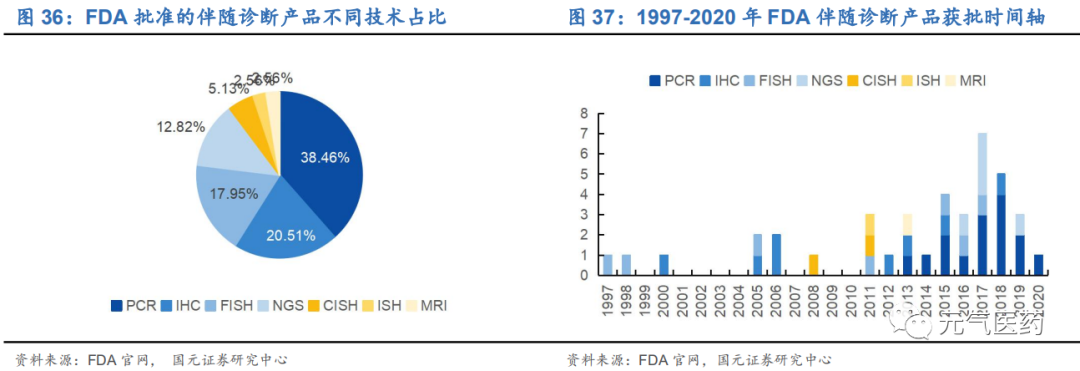
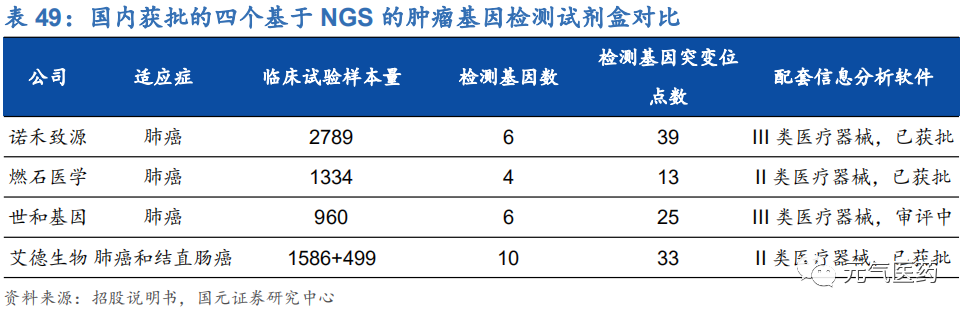
截止 2020 年 5 月,FDA 共批準 39 個 CDx 產品,其中 15 個為 PCR 產品,5 個為 NGS 產品,從產品分布來看, 目前 PCR 仍是主流選擇,而 NGS 近年來發展較快。從伴隨診斷產品獲批時間軸來看,近幾年 PCR 產品仍然是 FDA 青睞的技術類型。
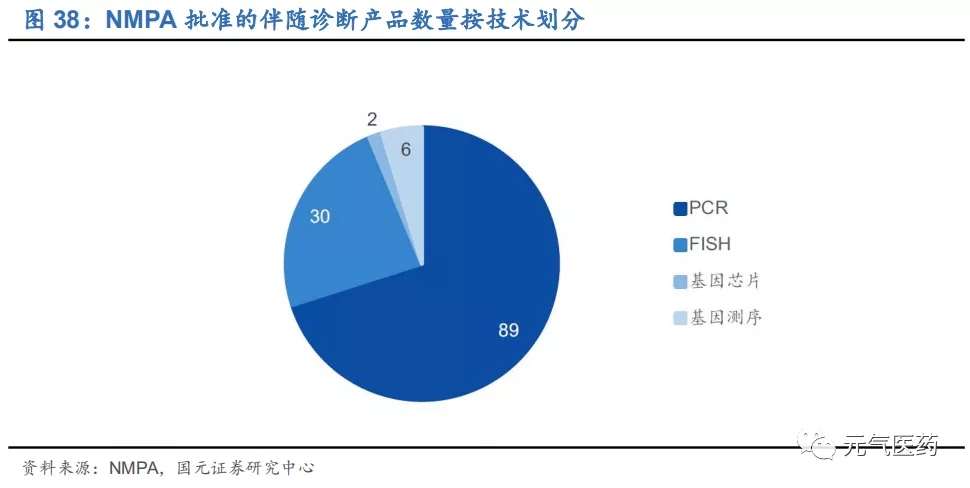
國內目前尚無明確的伴隨診斷相關法規,也沒有伴隨診斷相關產品的明確定義,因此相關檢測試劑主要通過第三類 醫療器械途徑獲批上市,2018 年 1 月,艾德生物的 Super-ARMS®EGFR 基因突變檢測試劑盒是首個以伴隨診斷試 劑標準獲批上市的 ctDNA 檢測試劑盒,為行業開啟新的里程碑。截止 2018 年底,運用分子診斷技術的腫瘤基因檢 測試劑盒共 129 個,其中 PCR 技術共 89 個,占比較大。
全球 CDx 市場規模 2019 年預計 37.6 億美元,國內約 3.95 億美元,國內行業增速超 30%。根據 Markets and Merkets 測算,2017 年全球 CDx 市場規模為 26.1 億美元,2016-2022 年年復合增長率將達到 22.78%;國內市場 規模相對較小,2017 年市場規模約為 2.22 億元,2012-2022 年年復合增長率為 28%,高于全球增長水平。未來隨 著靶向治療的概念不斷普及,市場有望保持高速發展。

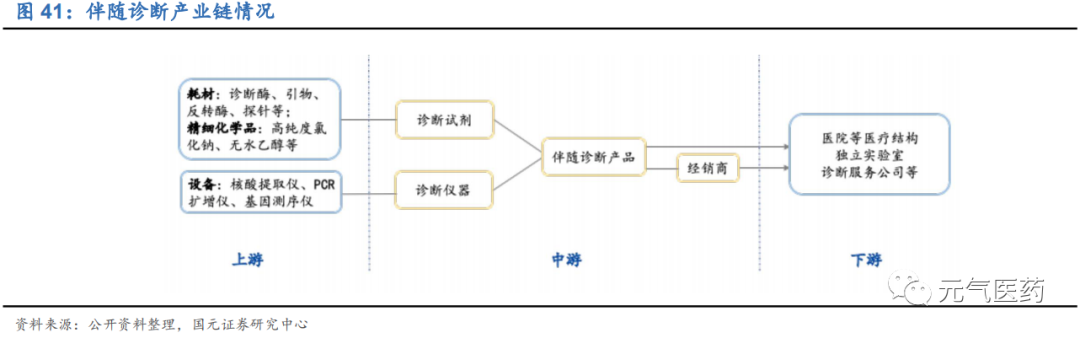
伴隨診斷產業鏈
上游:技術壁壘高,跨國巨頭壟斷,國內以代理業務為主,議價能力弱。基因測序、伴隨診斷行業上游是設備和耗材供應商:
設備主要為基因測序儀、PCR 擴增儀、核酸提取儀等,基因測序儀上游產業呈現壟斷格局,基本由 Illumina, Life Tech (Thermo Scientific 以 136 億美元收購)和 Roche 為主,2018 年 Illumina 的市場份額達 83.92%,穩居第一;LifeTech 和羅氏的市場份額分別為 9.88%和 5.32%。而核酸提取儀、PCR 擴增儀等技術門檻相對較低,目前已基本 實現國產化。
耗材包括酶、引物、探針等,上游原材料的廠商主要為國外巨頭企業,包括羅氏、Meridianlife science、Solulink、 Surmodics 等,因技術開發難度高,產業化成熟度低,國內企業以代理業務為主(上海起發、上海拜力生物等)。
中游:百花齊放,依托設備開發相應診斷產品。伴隨診斷中游主要是各類診斷試劑,目前主要由國產企業構成,通過自身技術平臺,開發各種診斷產品。
下游:主要包括醫療機構、第三方實驗室(ICL)和診斷服務公司,國內醫療機構占比較高,海外以 ICL 為主。伴隨診斷下游是采購使用試劑的用戶,包括醫院、第三方醫學實驗室、血站、體檢中心等。目前國內伴隨診斷采購方主 要仍以醫院病理科為主。檢測服務模式分為 3 種:患者-醫院、患者-醫院-服務公司(ICL 和診斷服務公司)和患者- 服務公司,前兩種以醫院為流量載體,是目前最普遍的服務模式,而第 3 種模式占比將隨著市場被教育程度的提高 而提高,ICL 和診斷服務公司將迎來進一步發展。此外,隨著醫保控費壓力擴大,對于特檢(病理及 PCR 診斷)這 類檢測項目,由于醫院樣本量不大且建設檢測中心成本較高等因素存在,醫院有較大的動力將特檢外包給獨立實驗 室進行檢測,因此獨立實驗室將有較大的發展空間。
2.2.2 腫瘤靶向治療必要程序,市場滲透率有望提升
對于基因突變原理已知并具有相應靶向藥物的疾病而言,使用伴隨診斷產品是不可或缺的步驟。腫瘤形成的主要原因為基因突變,而對于不同的突變原理,治療方式也不盡相同,因此在治療之前對基因突變類型的診斷就成為靶向 治療的必須步驟,目前海外臨床用藥指南中均已將伴隨診斷列入其中,要求靶向用藥必須伴隨精準的基因檢測。未來隨著國內靶向藥物的不斷上市和新藥研發的不斷推進,伴隨診斷行業也將乘勢快速增長。

靶向藥物納入醫保范圍且降價明顯,伴隨診斷產品滲透率有望提升。2017 年起醫 保局連續開啟了三輪醫保談判降價,大部分主流靶向藥價格得到了大幅度的下降, 2017-2019 年腫瘤靶向藥平均降幅達到 59%,極大程度的減輕了癌癥患者的經濟壓力,靶向藥需求量將有所上升。更重要的是,由于醫保政策要求患者使用醫保支付靶向藥物前必須經過靶點檢測以避免醫保資金浪費,因此醫保助推下的靶向藥市場規模擴大也意味著國內腫瘤精準醫療靶向用藥相關診斷產品的滲透率將得到提升。
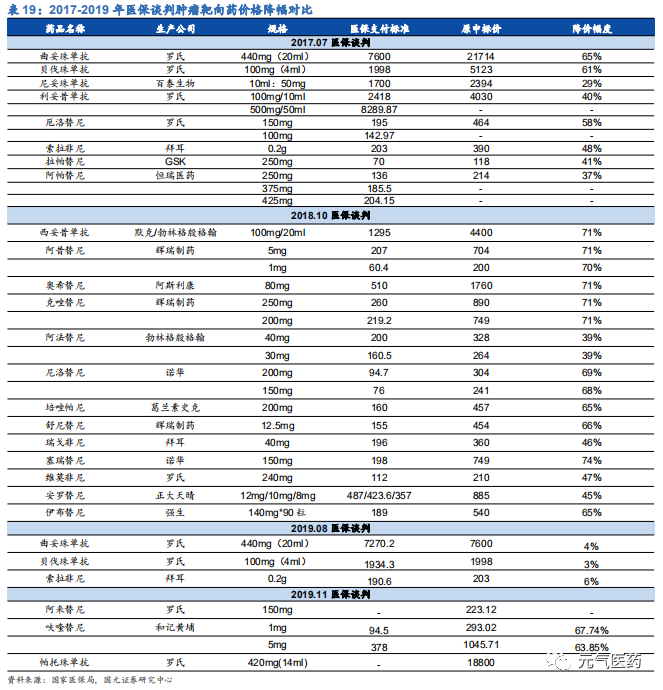
靶向藥納入醫保后銷售額實現快速增長,有望帶動伴隨診斷市場擴容。在靶向藥納入醫保之前,由于藥物定價較高, 大部分患者無法負擔巨大的藥物支出,因此,靶向藥在國內的滲透率一直處于較低水平,而伴隨診斷作為靶向用藥的先驅程序,也受到藥物市場的影響而導致滲透率較低,而未來隨著靶向藥進入醫保帶來的放量,伴隨診斷市場也有望實現快速增長。
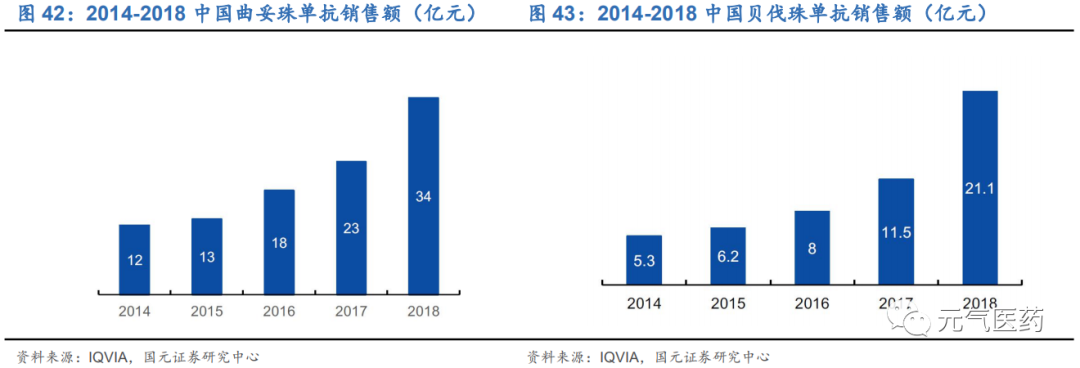
癌癥基因檢測納入北京醫耗聯動綜合改革,有利于規范伴隨診斷院內診療路徑。2018 年 12 月,北京市醫療保障局 印發《關于規范調整病理等醫療服務價格項目的通知》,規定腫瘤組織 DNA 測序納入醫保乙類,并限定價格為 3800 元,2019 年 6 月 15 日起,北京醫耗聯動綜合改革正式實施,全市執行病理檢測醫療保險新政策,這意味著腫瘤基 因檢測將正式納入醫保。長期以來,基因檢測的院外送檢市場較為紊亂,而北京市的醫耗醫保新政則意味著腫瘤基 因檢測的院內市場將逐步正規化。
2.2.3 腫瘤 CDx 市場空間巨大,滲透率有望提升
現階段伴隨診斷檢測人群數量達 125 萬,未來隨著新藥研發的推進,檢測范圍有望繼續擴大。目前靶向用藥主要集中于肺癌、胃癌、乳腺癌、結直腸癌、卵巢癌和黑色素瘤這幾種疾病中,根據全國腫瘤登記中心數據,我國肺癌、 胃癌、乳腺癌和結直腸癌等年新增患者人數均較多。
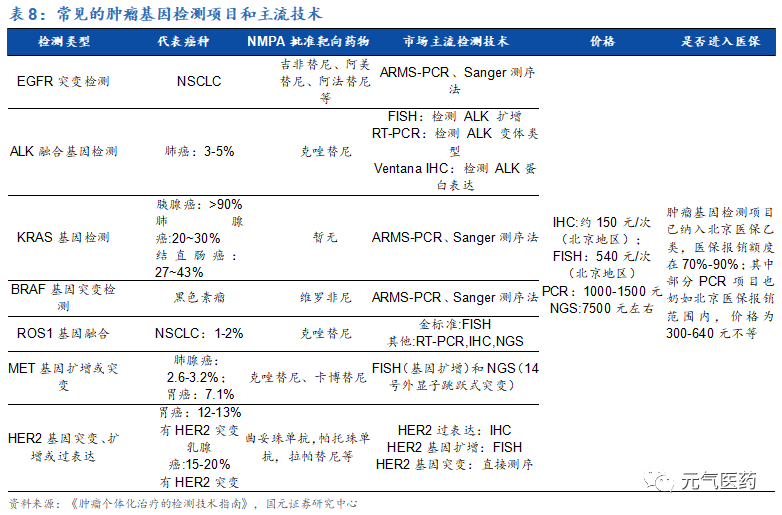
(1)肺癌已有較為成熟的靶向用藥,EGFR 突變、ALK 重排、ROS1 重排等患者在進行伴隨診斷后,可選擇相應的 靶向藥物,因此在肺癌領域中,這三個基因的 PCR 技術相對成熟,此外,隨著耐藥機制的深入研究,多基因 大 panel 的 NGS 試劑盒也進入市場,成為后續檢測手段;
(2)胃癌和乳腺癌主要通過檢測 HER2 陽性來選擇是否使用曲妥珠單抗等藥物,目前主要通過 FISH 或 IHC 來檢測 HER2 表達,檢測技術相對成熟;
(3)針對乳腺癌和卵巢癌中 BRAC1/2 的基因突變目前主要通過 NGS 的方式進行檢測,該突變比例目前相對較低,測序方式定價較高;
(4)結直腸癌中 EGFR/RAS 突變檢測是西妥昔單抗用藥的前置條件,主要通過 PCR 方式進行檢測。此外,在免疫 治療中,MSI/dMMR 的檢測也對后續治療有重要意義,可通過 NGS 進行檢測。
(5)此外,黑色素瘤的 BRAF V600E 檢測也可以指導相應用藥,可通過 PCR 實現。
(6)隨著 PD-1/PD-L1 免疫治療的快速發展,相應的 biomarker 也在不斷發展中,目前基于 IHC 的 PD-L1 檢測 和基于 NGS 的 TMB 檢測是較為主流的選擇方式,但從結果來看,并沒有對患者實現較好的區分,因此免疫 治療的精準靶向仍在研究和探尋中。
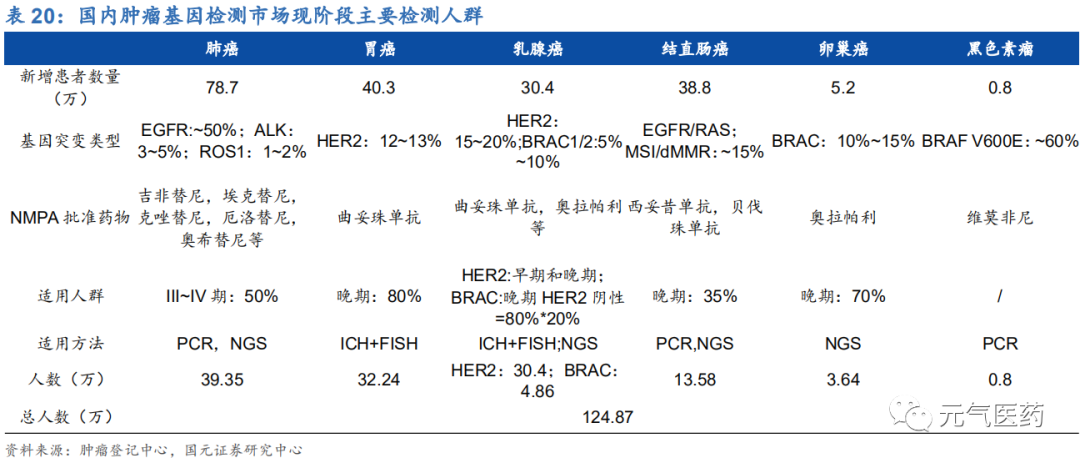
目前伴隨診斷滲透率不足 50%,隨著大 panel 和 NGS 產品滲透率提升,市場有望進一步擴容。單價:目前 PCR 產品較為成熟,市場定價 1000~2000 元,NGS 成本較高,市場定價在 5000 元以上,根據北京市 醫療保障局印發《關于規范調整病理等醫療服務價格項目的通知》, FISH 定價 540 元,IHC 定價 150 元。市場:目前腫瘤分子診斷主要以 PCR 和 FISH 為主,總市場規模約 11 億元,國內仍處于滲透率較低水平,不足 50%。NGS 由于定價較高,使用人群有限,總市場較小。市場擴容因素:
(1)行業發展:新的致病機制、新的基因位點發現、新的靶向藥物:從行業發展階段來看,目前精準醫療仍處于發展早期,最為成熟的肺癌領域目前也在不斷發展中,耐藥機制也使突變位點不斷增加,并出現 T790M、MET 等可 成藥的突變類型。此外,隨著新藥研發力度的增強,KRAS G12C、NTRK 等位點也正在被不斷攻克中,伴隨診斷產 品也將不斷豐富,市場有望進一步擴大。
(2)產品升級:單基因小 panel 產品將陸續被多基因大 panel 產品替代,有望帶動價格提升:PCR 技術目前已較為成熟,但主要用于已知突變,且一次性檢測基因數量有限,而對于患者來說,一次性檢測單個癌種的所有可能突 變類型更具有實際意義,大 panel 將成為產品升級替代的主要方向。此外,隨著免疫治療的興起,對于免疫微環境 的檢測也在探索和發展中,而在此基礎上 NGS 將有更大的發展潛力。
(3)滲透率提升:目前國內伴隨診斷的概念還在普及中,總體滲透率有望繼續提升。
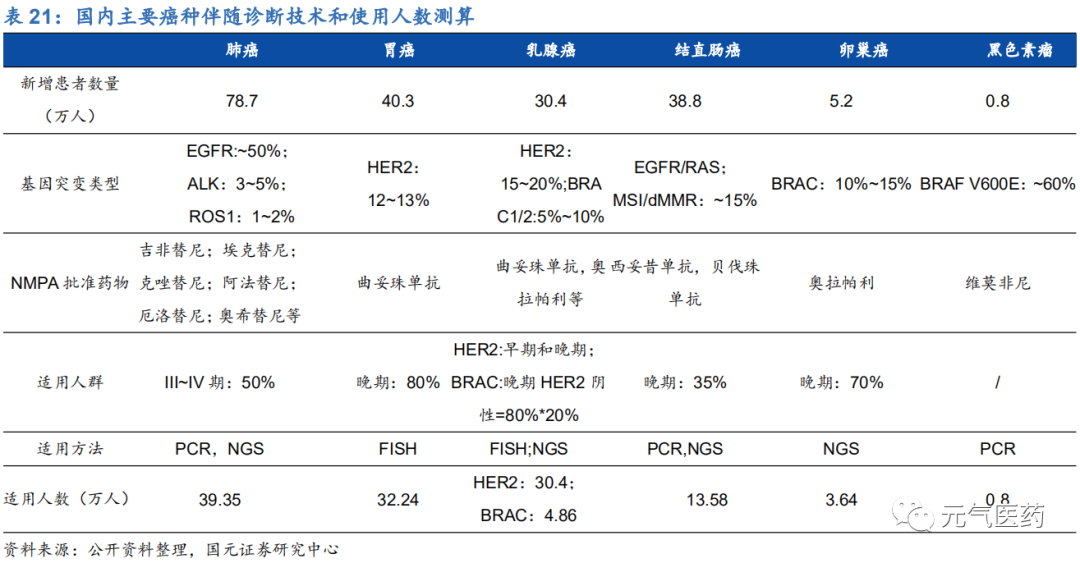
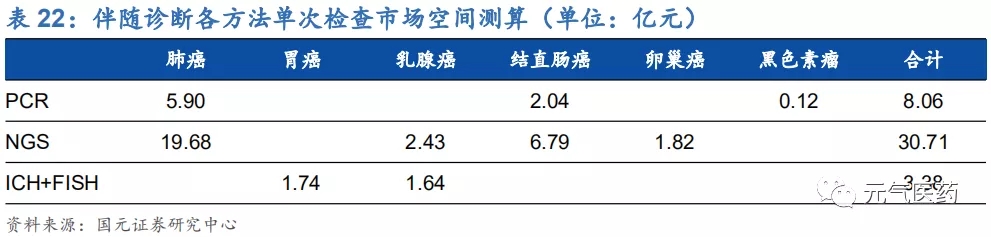
根據我們測算,肺癌、胃癌等 6 個癌種的 NGS 伴隨診斷市場規模約 31 億元,主要測算邏輯如下:
(1)假設各癌種每年新增患者中的晚期患者為潛在的伴隨診斷適用人群,根據不同癌種對應伴隨診斷技術的不同,對PCR、NGS、IHC&FISH三類技術進行市場空間測算;
(2) 根據市場數據顯示,目前各技術檢測平均單價分別為540元(FISH)、1500元(PCR)、5000元(NGS)。
2.2.4 PCR vs NGS:優勢互補,長期共存
就國內目前行業發展階段而言,NGS 雖然應用前景廣泛,但仍處于初步發展階段,短期內仍然面臨包括發展模式尚不成熟、部分技術瓶頸尚未解決、成本較高、入院困難等諸多難題,對 PCR 市場份額的沖擊較小:
上游NGS測序儀市場集中度較高,中游企業議價能力弱:國內基因測序公司多分布在中下游產業鏈,利潤空間較小,因此國內NGS廠商在未來開拓市場方面瓶頸較大。國內伴隨診斷龍頭企業艾德生物目前也仍然是PCR為主、NGS為輔的布局模式,因此中短期來看,PCR和NGS技術仍將共存于分子診斷市場。
NGS成本和操作復雜度較高,管理規范尚未成熟:雖然目前NGS成本在逐漸降低,但在未來較長時間內仍將持續高于PCR等傳統技術,NGS技術在醫院的普及率較低,醫院檢驗科通常將測序業務外包給第三方基因測序公司,而且得到檢驗結果耗時較長(一周以上),而PCR技術由于進院早、應用成熟,檢驗科操作熟悉并且獲得 檢驗結果時間較短,同時受PCR產品高盈利的驅動,檢驗科會傾向于選擇性價比較高的PCR技術。
PCR 和 NGS 之間是互補而非替代的關系:
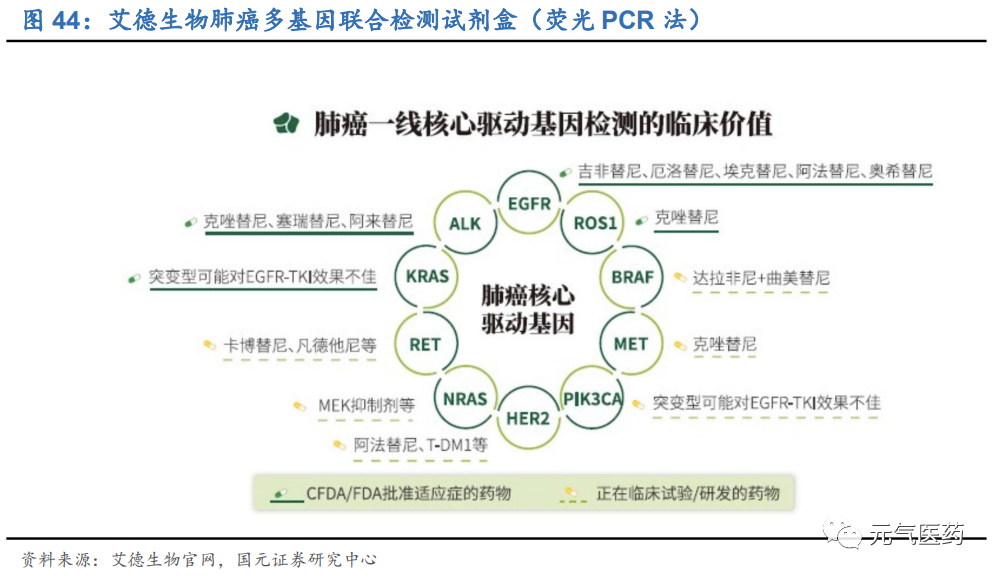
(1)就目前靶向治療現有靶點而言,PCR 檢測基本滿足需求
對于大部分癌癥而言,已有上市靶向藥物的靶點數量均不超過 10 個,以靶向藥物最豐富的的肺癌為例,現有 PCR 診斷產品即能滿足肺癌一線核心驅動基因的快速檢測需求,比如艾德生物推出的可以新一代多基因聯合檢測試劑盒(商品名:艾惠健)上市。該試劑盒可同時檢測肺癌 EGFR、ALK、ROS1、KRAS、BRAF、HER-2、RET、MET、 NRAS、PIK3CA 等核心驅動基因, 覆蓋了肺癌已上市甚至未來 3~5 年潛在上市靶向藥物所有的核心基因靶點,因此 PCR 未來幾年足以滿足肺癌基因檢測的需求。
(2)基因檢測數量并非多多益善
對于某種特定的癌種而言,有檢測價值的基因應該滿足兩個條件:(1)該癌種里面出現的突變基因;(2)能預測靶向藥物效果。基因檢測要根據實際需要評估的靶向藥物,選擇相對應的基因檢測項目。目前已上市的靶向藥物比較固定,當測序覆蓋足夠靶點基因后,再增加基因數量未必能提供更多的靶向藥物指導。對于某癌種中突變極少發 生的基因或者目前沒有針對性靶向藥物的基因,檢測的意義不大。比如在乳腺癌和卵巢癌中突變很多的 BRCA 基因, 在肺癌在極少出現突變,再比如肺癌中突變經常發生 SMARCA4 基因,由于沒有針對性藥物,即使檢測出突變也沒 有預測藥物療效的價值。
目前大部分靶向藥物需要檢測的基因不超過 10 個,且國內已獲批通過的 4 個腫瘤 NGS 試劑盒最多也僅能覆蓋 10 個靶點,腫瘤類型也僅限于非小細胞肺癌(NSCLC)和結直腸癌,NGS 的技術特性決定了其優勢主要體現在中、大 panel 領域,比如貝瑞基因旗下子公司和瑞基因于 2020 年 7 月推出的實體瘤全靶點基因檢測產品(“654 大 Panel”) 屬于 NGS 檢測中的大 Panel 檢測,可以同時檢測 654 個基因,覆蓋了已經獲批和現在的腫瘤標志物。而對于檢測基因數量在 10 個以下的靶向藥物,PCR 相比 NGS 具有操作簡單、準確率高、出報告時間短、性價比高等顯著優勢,將成為大多數醫院和患者的最優選擇,NGS 則滿足小部分患者的需求。我們認為未來 3-5 年 PCR 基本能滿足大部分臨床檢測診斷需求。

(3)PCR 適合基因位點已知、對靈敏度要求較高的檢測,NGS 在發現未知基因方面則更具優勢;qPCR 更適合腫瘤組織樣本的臨床基因診斷,NGS 在血液 ctDNA 檢測方面更具優勢。
根據中華醫學會檢驗醫學分會和國家衛建委 2019 年聯合制定的《液體活檢在臨床腫瘤診療應用和醫學檢驗實踐中的專家共識》,檢測已知、單個靶向治療敏感或耐藥型突變時,建議使用 ARMS-PCR 方法;檢測已知、多個平行臨床 治療靶點或發現未知基因、探索臨床價值與相關機制時建議使用 NGS 方法。
(4)PCR 和 NGS 的應用和靶點種類以及推薦治療靶向藥物相關
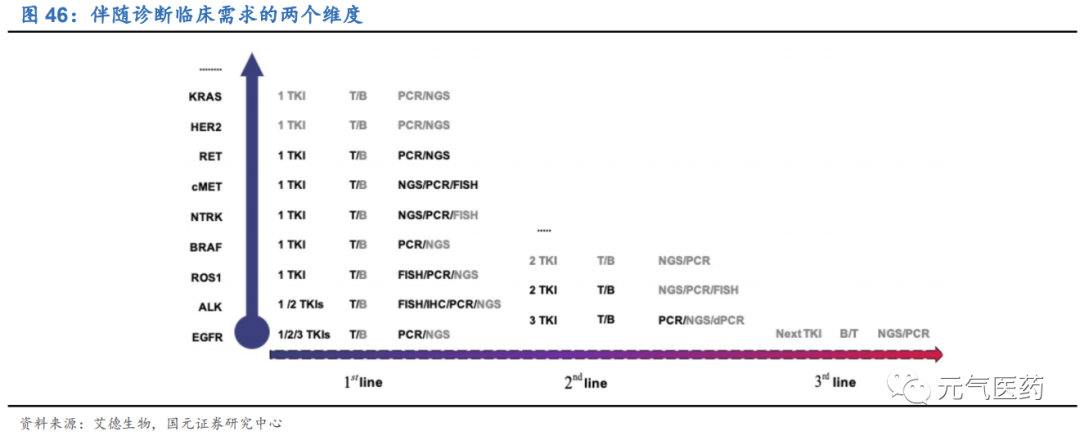
伴隨診斷臨床需求的兩個維度分別是是靶點和治療方案,在目前已開發的一線治療靶向藥物中,針對 EGFR、BRAF 等靶點的伴隨診斷采用 PCR 技術,而 NTRK、RET 等靶點則是 PCR 和 NGS 共存;二/三線治療靶向藥的伴隨診斷目前僅適用于 EGFR 和 ALK 靶點,其中 EGFR 突變使用 PCR 技術,而 NGS 尚未得到有效應用。
2.2.5 小結:伴隨診斷賽道景氣度高,天花板逐步提升
伴隨診斷是分子診斷技術比較成熟的應用領域之一,目前處于 PCR 技術為主、NGS 為輔并快速發展的局面,在技術發展、新靶點和新靶向藥物的不斷發現、更多靶向藥物以及伴隨診斷產品納入醫保等驅動力下,行業持續發展驅動 力強,景氣度高。
(1)目前伴隨診斷技術以 PCR 為主,隨著 NGS 快速發展,未來將呈現相輔相成、優勢互補的局面。PCR 憑借原理簡單、操作性強、價格較低的優勢成為現階段伴隨診斷主流技術;NGS 一次可以檢測多個基因,長期來看 NGS 的廣泛使用是必然趨勢,但中短期來看對現有市場沖擊有限,以 PCR 技術為基礎的伴隨診斷產品是腫瘤一線治療檢 測的主要解決方案,不會迅速被 NGS 取代。PCR 技術與 NGS 技術優勢互補,分別滿足不同場景的臨床檢測需求, 將在相當長的一段時間內共存發展;
(2)未來市場增長主要來自傳統癌種的存量市場以及新靶向藥物的增量市場。存量市場:主要來自傳統癌種(肺癌、結直腸癌、乳腺癌等)檢測產品滲透率/人均檢測次數/人均客單價提升;增量市場:主要來自新靶向藥物上市帶來的伴隨診斷產品的開發。
國內艾德生物和燃石醫學分別是 PCR 和 NGS 伴隨診斷領跑者,先發優勢明顯。艾德生物憑借多年的技術優勢和產品布局成為伴隨診斷行業領跑者,產品管線豐富,核心競爭力強,渠道和品牌優勢明顯,PCR 領域基本實現進口替 代;從中長期發展來看,公司后續 BRCA 試劑盒、9 基因檢測試劑盒等產品有望為公司業績帶來增量,同時公司積 極 和強生、阿斯利康等知名企業合作,在伴隨診斷產品上市、產品銷售渠道下沉方面逐步發力,最大程度享受行業發展紅利,疊加國外市場逐步打開,公司業績未來可期。在 NGS 伴隨診斷領域,燃石醫學是腫瘤 NGS 伴隨診斷領 域龍頭,憑借核心技術優勢于 2018 年拿下國產“腫瘤 NGS 試劑盒第一證”,目前在腫瘤 NGS 伴隨診斷市占率第一。
2.3 腫瘤早篩:前景廣闊,市場容量巨大
2.3.1 腫瘤早篩意義重大,顯著提升患者生存率
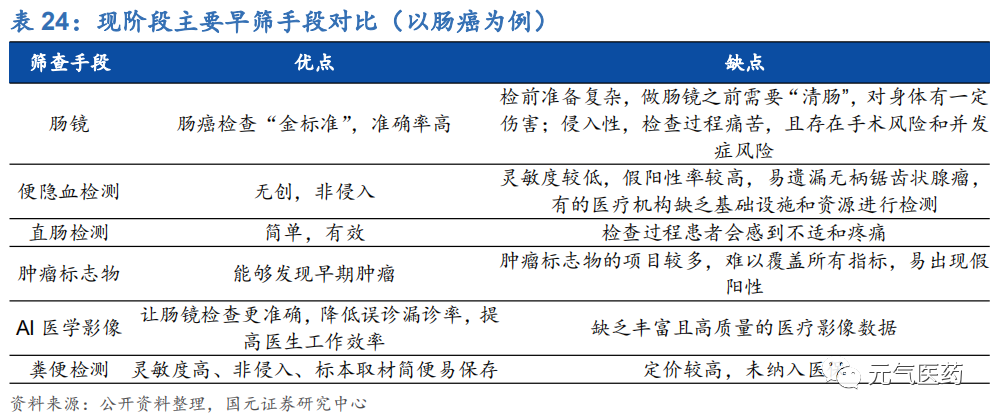
腫瘤早篩是指用快速、簡便的方法,從大量看起來健康、尚未出現癥狀的目標人群中篩選出極少數腫瘤高危群體,能夠及早發現腫瘤,降低發病風險,尤其是發病率高、死亡率高、發展周期足夠長的癌種,比如肺癌、胃癌、結直腸癌等。以結直腸癌為例,中國人群結直腸癌的5年生存率在I、II、III、IV其分別為95%、73%、54%和8%,因此,腫瘤的早發現和早診斷對于提升患者的生存率至關重要,同時也能減少國家和個人的醫療支出負擔。根據世界衛生組織數據,1/3的癌癥可以通過早期發現得到治療。
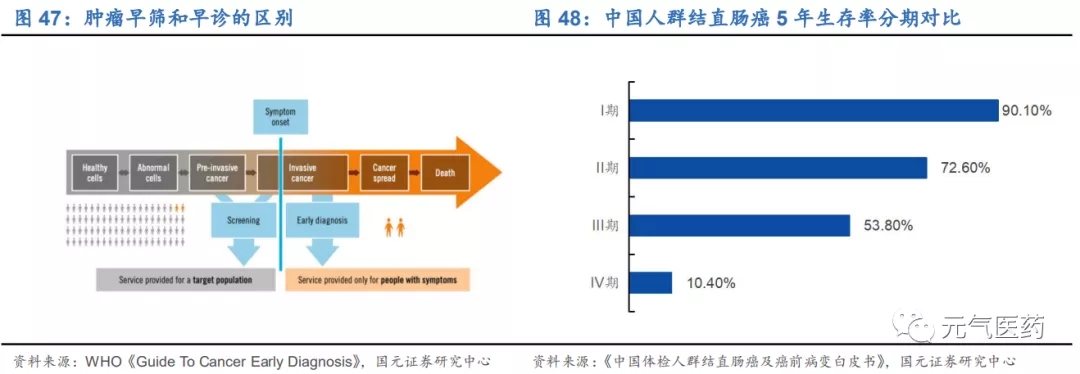
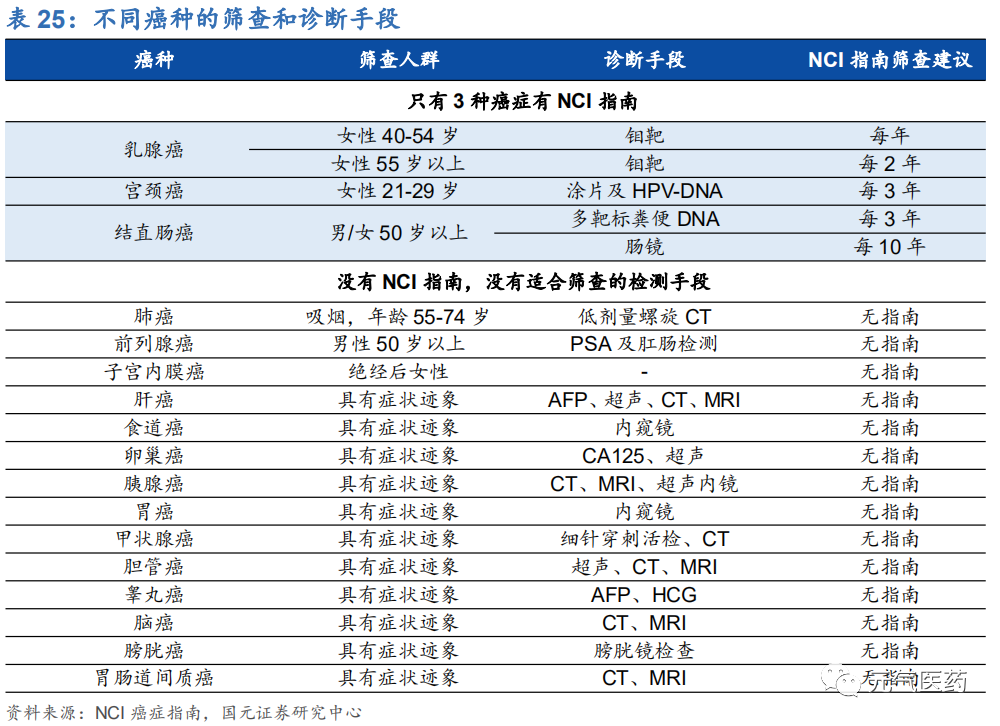
現階段早篩手段有諸多局限性,并且多數癌種尚無有效的早期檢測手段。現階段腫瘤早篩主要依靠內鏡、影像學檢測(低劑量螺旋 CT 等)、組織活檢等傳統檢測手段,普遍存在一定的局限性,而且敏感度和特異性都不夠理想。其中內鏡(胃鏡和腸鏡)雖然能夠較早期發現食管癌、胃癌和腸癌,但內鏡檢查具有侵入性創傷,檢查過程痛苦,對病人體質要求較高,且不包括在常規體檢項目中,導致篩查滲透率較低;影像學手段通常具有輻射性,而且對早期腫瘤的識別力較低;組織活檢取樣困難,且由于腫瘤的異質性容易造成取樣不完全,不利于診斷分型又容易導致并發癥,同時假陽性和假陰性概率也較高。同時,目前多數癌種尚無有效的早篩手段,根據美國國家腫瘤中心(NCI) 指南,目前僅有乳腺癌、宮頸癌和結直腸癌有 NCI 推薦的篩查手段,其中乳腺癌早篩使用的鉬靶技術仍具有輻射、產生疼痛感等缺陷,其他多數腫瘤類型沒有 NCI 指南推薦的適合篩查的檢測手段。
2.3.2 他山之石:日本胃癌篩查五年生存率高達 80%
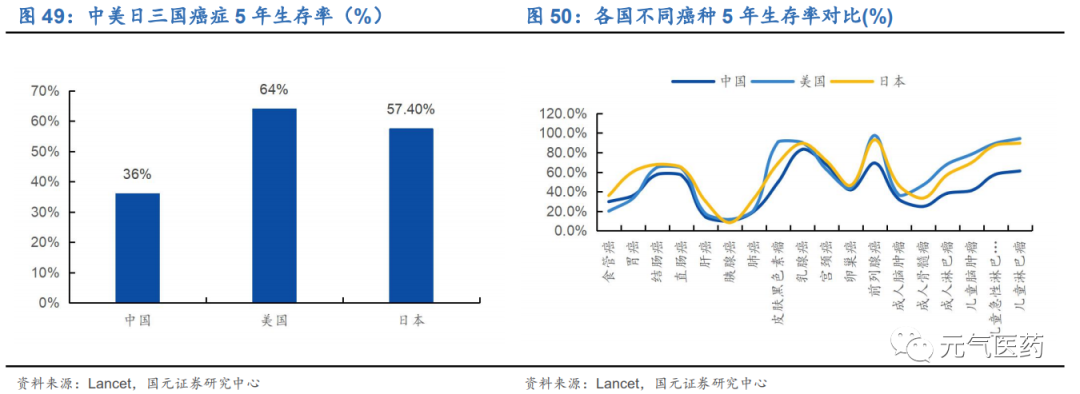
根據 2018 年《柳葉刀》全球腫瘤生存趨勢檢測報告顯示,我國整體腫瘤 5 年生存率為 36.0%,遠低于美國的 64% 和日本的 57.4%。以胃癌為例,中國胃癌病人的 5 年生存率僅為 20%,和日本 80%的胃癌 5 年生存率差距較大。日本胃癌患者 5 年生存率處于世界領先水平,主要原因包括:
胃癌內鏡篩查技術較高:日本的早期胃癌內鏡診治水平一直處于世界領先地位,其中窄帶成像聯合放大內鏡是 診斷早期胃癌的重要工具,在日本較為普及;
政府鼓勵全民篩查:日本早在 1983 年開始實施全國范圍內的胃癌篩查,到 1990 年后,每年約有 600 萬人進行胃癌篩查;2015 年,日本修改《胃癌篩查指南》,將內鏡篩查作為胃癌篩查方法;
醫保支付:日本要求 40 歲以上的人每年按規定的時間做一次胃鏡或胃癌篩查,費用由保險公司買單。如果按 規定做篩查發現了胃癌,所有治療費由保險公司支付;如果不按規定進行篩查,若被診斷出胃癌,全部診治費 自理。
國內整體腫瘤生存率較低的主要原因是技術手段、政府支持不足,同時國民早篩觀念也有待加強。盡管在我國胃癌高發地區的高危人群中實施了政府主導的胃鏡免費篩查項目,但并沒有將胃癌機會性篩查納入醫保支付范圍,一定 程度上限制了民眾做胃鏡篩查的積極性,同時胃鏡對于內鏡醫師的技術水平要求較高,經濟發展水平較低的地區缺 少足夠的內鏡醫師資源,覆蓋率也有所降低。要真正實現腫瘤早篩的全面普及,一方面需要技術的突破和民眾早篩意識的提升,另一方面需要政策推動以及醫保支付端覆蓋。
2.3.3 政策推動腫瘤早篩發展,覆蓋率有望逐步擴大
政策推動腫瘤早篩持續向好發展。目前我國腫瘤發病率和病死率都居于世界前列,每年花在腫瘤治療上的費用超過 2200 億元。過去十年,政府已經成為推動癌癥早篩領域發展的重要力量,推出多項政策促進癌癥的早篩早診。2016 年國務院發布的《“健康中國 2030”規劃綱要》提出要強化慢性病篩查和早期發現,對高發地區重點癌癥開展早診早 治工作,推動癌癥、腦卒中、冠心病等慢性病的機會性篩查,并提出到 2030 年要實現全人群、全生命周期的慢性病 健康管理,總體癌癥 5 年生存率提高 15%;《2019 年政府工作報告》指出“要實施癌癥防治行動,推進預防篩查, 早診早治和科研攻關,著力解決民生痛點”。此外,部分地方政府已經開展癌癥篩查項目,提供免費篩查服務,進一 步提高癌癥早篩早診的覆蓋面。
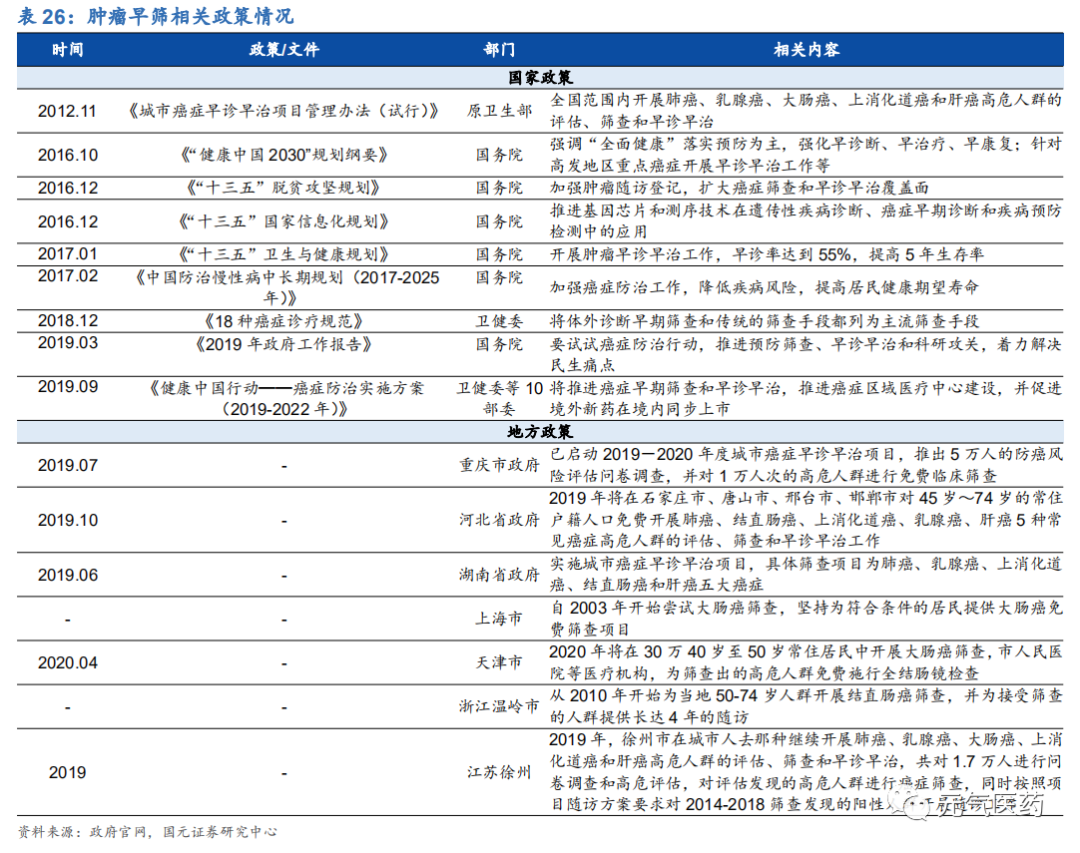
2.3.4 國內外企業加速布局腫瘤早篩市場,液體活檢是新方向
液體活檢彌補常規早篩手段缺陷,市場容量大。胃鏡、腸鏡、組織活檢等常規癌癥篩查方法雖然應用廣泛,但是存在侵入性、取樣困難、敏感度較低等諸多問題。近幾年,基于 PCR、NGS 等分子診斷技術的液體活檢發展迅速,在 腫瘤早篩中應用前景廣闊。液體活檢是指一種非侵入式的血液測試,能檢測腫瘤或其轉移灶釋放到血液中的循環腫瘤細胞(CTC)和循環腫瘤 DNA(ctDNA)碎片和外泌體,從而判斷腫瘤的基因突變情況。相比傳統的早篩手段, 液體活檢具有取樣方便、靈敏度高、非侵入性、有效應對腫瘤異質性、在疾病發展的不同階段可重復取樣等優勢。雖然目前仍處于研究階段,但應用前景十分廣闊。
國外市場:仍處于研究階段,前瞻性驗證結果取得突破
國外液體活檢在腫瘤早篩的應用仍處于研發階段,代表性企業包括美國液體活檢龍頭 Guardant Health、癌癥早篩 Grail、Epigenomics、Exact Sciences 等,腫瘤早篩分為單個癌種早篩和泛癌種早篩:
單癌種早篩:目前以結直腸癌為主,已有 Epigenomics、Exact Sciences 兩家公司的結直腸癌早篩產品獲得 FDA 批準;
泛癌種早篩:相比單癌種早篩,泛癌種早篩需要同時檢測跟多指標,對敏感性要求較高,目前仍處于前瞻性驗 證階段,代表企業包括 GRAIL、Thrive 等,2019 年 Grail 開發發的針對乳腺癌、結直腸癌、胃癌等 14 個癌種的早期篩查被 FDA 批準為突破性設備(Breakthrough Devices),對于全球癌癥早篩領域是一個里程碑事 件。2020 年 4 月,美國 Thrive 公司研發的血液檢測產品在針對接近 10000 名無癌癥患病歷史的健康女性的 前瞻性試驗中,結果顯示該檢測產品能夠發現常規篩查無法發現的早期癌癥患者,血液篩查和常規篩查并用能 夠將檢查出的癌癥患者數目翻倍,這是全球首個前瞻性、國際性癌癥早篩血液檢測研究的結果,可將假陽性結 果降至 0.4%。
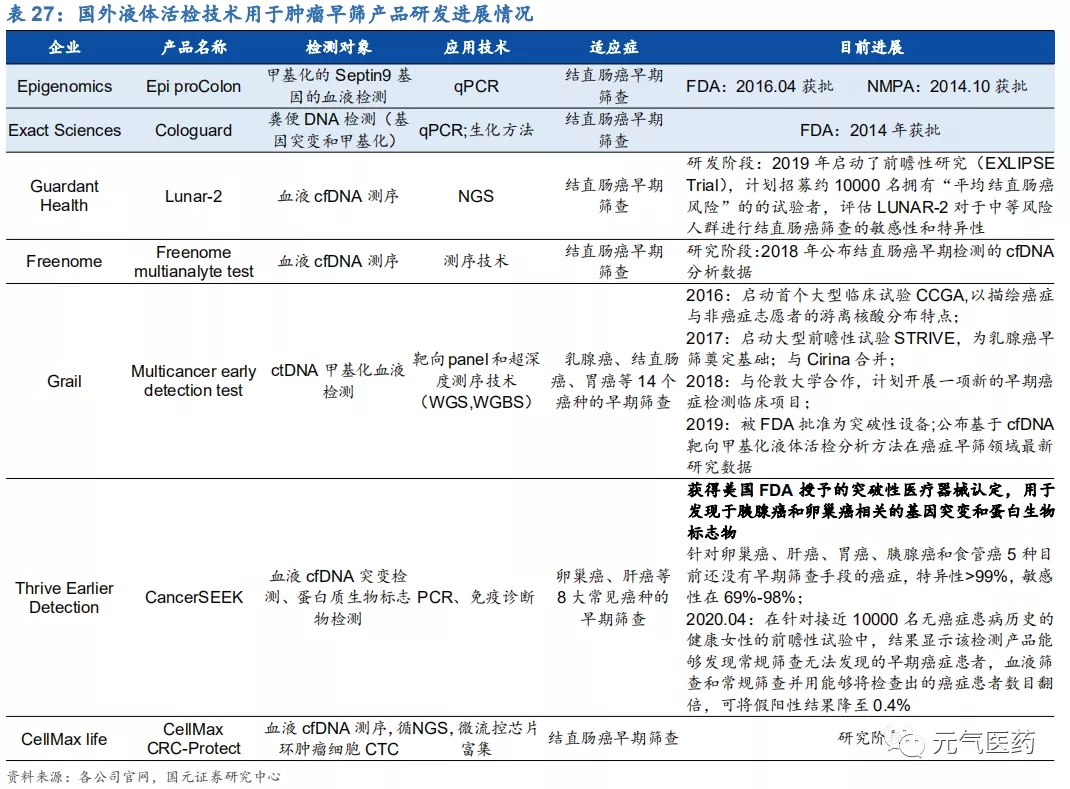
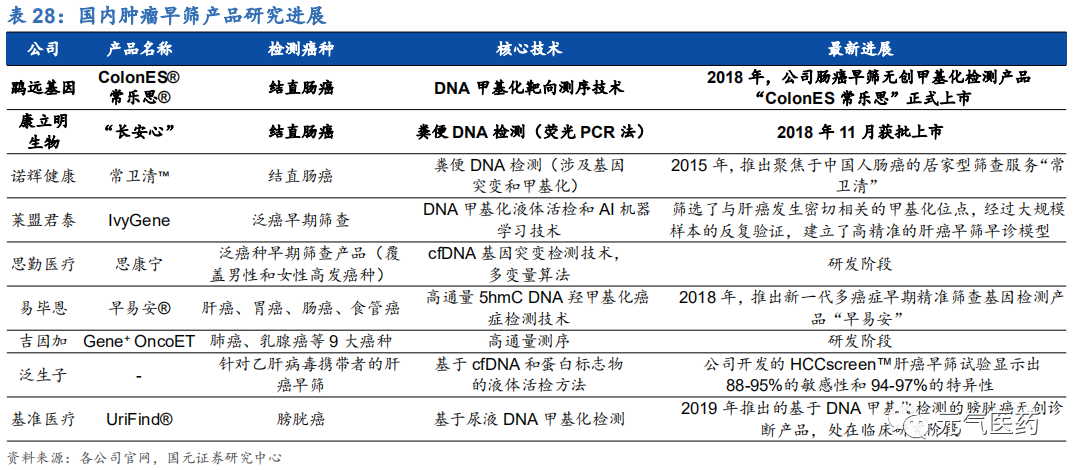
國內企業:尚處于起步階段,積極拓展早篩服務
國內腫瘤早篩行業仍處于起步階段。國內腫瘤早篩市場仍處于行業發展的早期階段,但絕大的市場空間吸引了眾多新興生物科技公司的布局,包括鹍遠基因、思勤醫療、吉因加、萊蒙君泰、易碧恩等,此外貝瑞基因、艾德生物、 透景生命等傳統的腫瘤基因檢測也開始將腫瘤早篩納入其業務范疇,其中貝瑞基因的肝癌早篩項目 Precar 已經取得 重大突破,在特異性 100%的情況下,肝癌的檢測靈敏度超過 97%,從臨床數據看具有很高的價值。目前大多數公 司開發的腫瘤早篩產品主要針對結直腸癌、肝癌和肺癌等常見的單一腫瘤類型,萊蒙君泰、思勤醫療、吉因加等少數公司研發了泛癌種早篩產品,其中結直腸癌早篩進展較快,目前有鹍遠基因、康立明生物的結直腸癌早篩產品獲得 NMPA 批準上市。
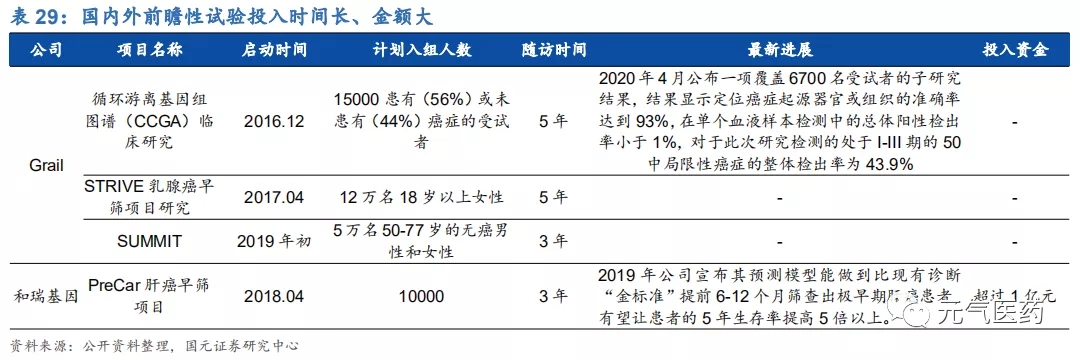
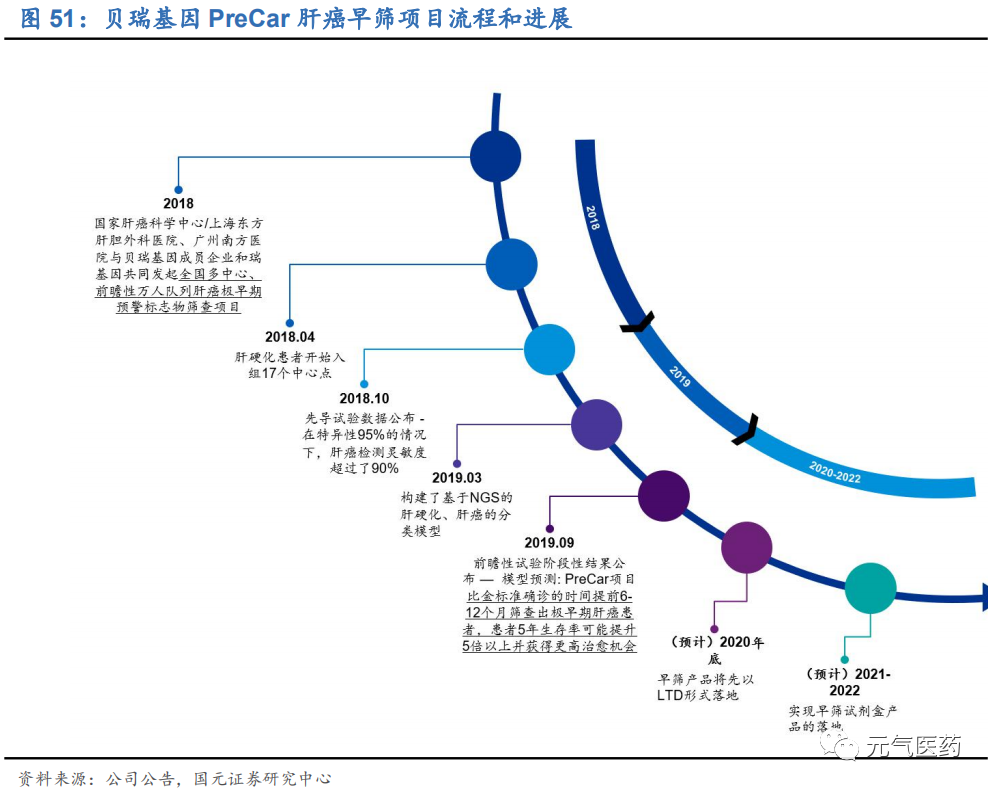
大規模的前瞻性臨床試驗室腫瘤早篩應用的基礎,產業化道阻且長。腫瘤的產業化過程主要包括“底層技術開發-回顧建模-前瞻驗證-產業化”四個階段,其中前瞻驗證階段需要投入大量的時間和精力,受試群體規模大,而且至少需要 3 年的隨訪,資金投入量在億元以上,臨床數據的驗證是布局腫瘤早篩領域企業間競爭最重要的差異化因素。目前大部分企業仍然停留在回顧建模階段,有能力開展前瞻性試驗的企業較少。其中,美國早篩龍頭 GRAIL 斥資上億美元 先后開展了 CCGA、STRIVE、SUMMIT 等臨床試驗,在前瞻性驗證階段處于領先水平;國內企業中貝瑞基因旗下和 瑞基因于 2018 年啟動的 PreCar 肝癌早篩項目是全球最大、進展最快的肝癌前瞻性隊列研究,在國內外同類研究者均處于領先水平,預計 2020 年在試點醫院/第三方檢驗機構以特檢的形式落地,正式進入商業化階段。
貝瑞基因 PreCar 肝癌早篩項目 貝瑞基因子公司和瑞基因的 PreCar 肝癌早篩項目由國家肝癌科學中心、南方醫科大學、貝瑞基因子公司和瑞基因聯合發起的全國多中心超大規模肝癌早篩前瞻性隊列研究項目,也是全球同類研究中規模最大、進展最快的肝癌早篩臨床研究項目,無論是回顧性還是前瞻性試驗,PreCar 的技術水平都處于世界前列。
PreCar 模型區分腫瘤/高危患者的能力達到同類研究領先水平。針對肝癌,PreCar模型通過獨特的多組學整合早篩技術,構建完成底層通用技術平臺和 AI 分析框架。根據此前的試驗結果,在肝癌 VS 健康人群的研究中:特異性 99%、 敏感性 100%,AUC(曲線下面積) > 99.9%;在肝癌 VS 肝硬化人群的研究中:特異性 96%,敏感性 93%,AUC >99.8%。這些成果證明 PreCar 模型區分腫瘤和高危人群的能力達到了全球同類研究的領先水平,并為后續的前瞻性 隊列研究預測肝癌極高危人群奠定堅實基礎。
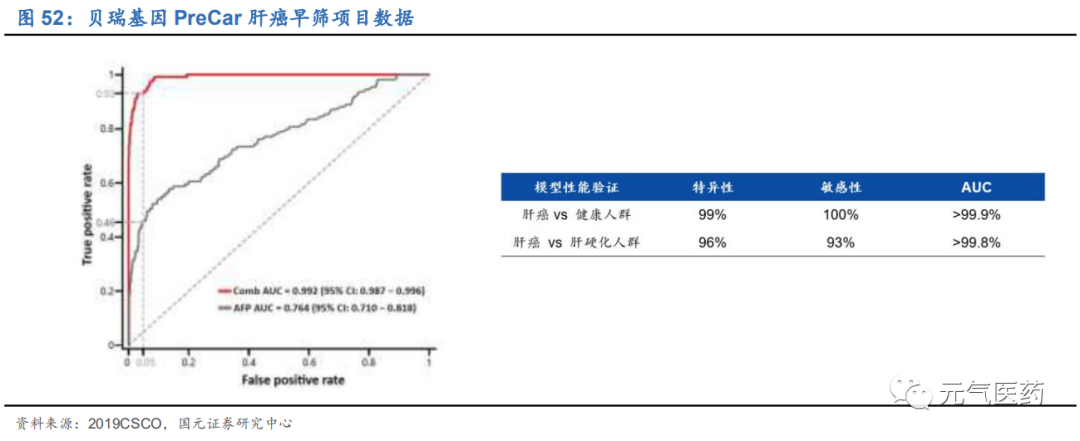

提前金標準 6-12 個月查出肝癌,患者 5 年生存率或將提升 5 倍以上。2019 年 CSCO 大會上,和瑞基因公布了 PreCar 項目階段性研究結果。研究結果顯示,經過 PreCar 模型篩查出的第一批 55 例肝癌極高危人群,在隨后 6 個月內的隨訪中,已有 8 例被確診為新發早期腫瘤,較完成隨訪患者的轉癌率富集了 13 倍以上。尤其值得注意的是,這部分 患者的腫瘤大小都在 0.8—2.5 厘米之間,全部處于肝癌早期,其中約 75%處于肝癌極早期。常規臨床診斷的早期肝 癌患者通常不足 20%,極早期的比率更是不足 10%,同時根據相關文獻在肝癌早期確診的病人,5 年生存率為 50-70%,而晚期肝癌患者 5 年整體生存率近 10-19%,這意味著經 PreCar 項目篩查出的人群 5 年生存率有望提升 5 倍。此外,在前瞻隊列經基于預測模型將肝癌檢出的時間比金標準診斷時間提前了 6-12 個月,實現了真正意義上 的早篩,是全球同類項目中的首次突破。
液體活檢精確度和準確度有待提高。目前腫瘤早篩臨床進展迅速,但要達到成熟和完善的水平,還需在技上實現三個層面的突破:(1)從血液中檢測到 ctDNA 突變:早期診斷標志物尋找困難主要源于早期腫瘤的循環腫瘤 DNA (ctDNA)在血液中含量非常低,相比中晚期的百分之幾或者千分之五以上的水平,早期可能低至萬分之一,即使 NGS 測序的精確度也只達到千分之一,而通過加大測序深度提高檢測靈敏度存在假陽性的風險,因此如何提高 NGS 的精確度實現突變的檢測仍有待完善;(2)建立起 ctDNA 突變和腫瘤之間的關系:構建大樣本研究和數據分析,進一步明確基因突變源于哪種腫瘤;(3)實現從 ctDNA 檢測到癌變器官的溯源:判斷變異基因來自哪個器官,實 現精準的預防或干預;(4)基于 NGS 液體活檢檢測靈敏度和準確性還有待大幅提升:腫瘤個體化差異大,從病灶釋放到血液中的 DNA 在不同階段和時間會有很大差異,而且 ctDNA 的半衰期只有 2 個小時,所以即使同一個人在 不同時間的 DNA 檢出量也會有較大差異。
2.3.5 小結:市場擴容動力十足,PreCar 肝癌早篩項目或成行業標桿
相比“擁擠”的腫瘤個體化治療領域,腫瘤早篩尚處于“藍海”市場,巨大潛在需求吸引國內外企業加速布局并搶占市場份額。腫瘤早篩賽道仍處于前期研究階段,其核心技術液體活檢仍有諸多瓶頸亟需攻破,但千億級市場潛在規模吸 引國內外企業加速布局腫瘤早篩市場。
未來市場的驅動力主要來自政策、技術和市場需求三個層面:
(1)政策:在一系列政策加持下,國內癌癥早篩市場逐步規范化,醫保支付和不同癌種早篩指南將逐步擴大腫瘤早 篩的覆蓋面,市場滲透率有望加速提升;
(2)技術:液體活檢的細胞腫瘤(CTC)、腫瘤細胞 DNA(cDNA)等診斷技術發展快速,目前 Grail、貝瑞基因等 國內外優質企業已經取得一定的突破并在大規模前瞻性驗證階段表現突出,未來隨著技術逐步完善、成本不斷降低, 腫瘤早篩將成為常態化;(3)市場:目標人群主要是健康人群,群體基礎廣闊,且近幾年民眾體檢意識不斷增強,體檢人次從 2011 年的 3.44 億人次增長至 2018 年的 5.75 億人次,同時伴隨著重大陽性檢出率的提升,讓民眾越來越意識到腫瘤早篩的重要性。然而,精準定位市場需求和診療路徑或將成為突破口。
我們看好貝瑞基因 PreCar 肝癌早篩項目,預計有望成為早篩成功標桿:
1)精準定位需求:以潛在高危人群為主,如容易發展成肝癌的已知肝硬化、肝炎患者,相較于普通健康人群,具有更高意愿進行肝癌相關早篩。
2)精準定位診療路徑:應用場景可拓展至醫院院內,不局限于體檢機構及一年一次的體檢頻率。肝癌高危人群通常 需要維持每季度/半年一次的肝功能相關檢查,PreCar 肝癌早篩項目可進院嫁接在常規隨訪上。
2.4 傳染病檢測市場
2.4.1 新冠檢測:核酸檢測是金標準,疫情下試劑檢測需求大增
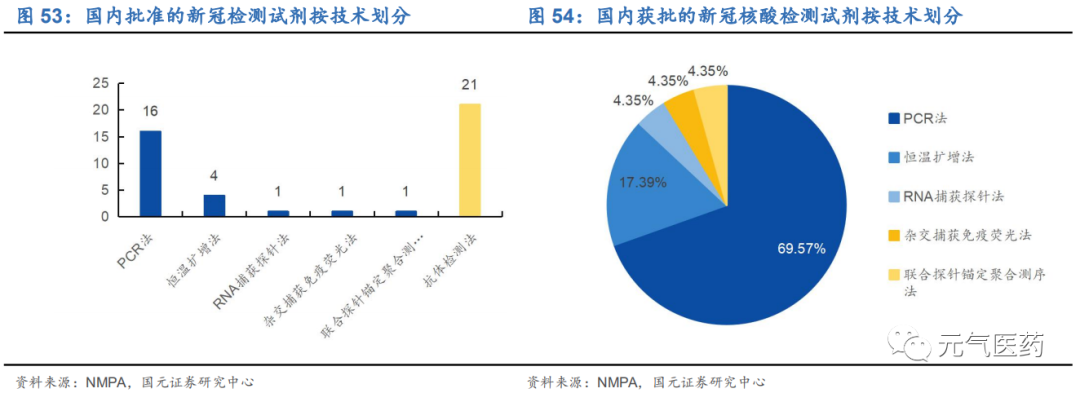
新冠疫情形勢不容樂觀,特效藥或疫苗出現之前新冠檢測試劑是主要防控手段。從 2019 年 12 月國內新冠肺炎疫情發生起,到如今發展到全球多區域爆發的情況,全球范圍內已進入防控的新常態,境外仍處于高發態勢,確診人數 持續增加,截至 2020 年 8 月 12 日,全球累計新冠肺炎確診 2038 萬例,且還有增長的趨勢。在可以廣泛使用的特效藥或疫苗出現之前,使用核酸檢測和抗體檢測試劑盒的常規篩查途徑將成為快速篩查出新冠患者、最大程度減少新冠傳播的有力手段。截至 2020 年 7 月底日,全國醫療衛生機構進行核酸檢測的累計數據達到 1.6 億人份,核酸 檢測試劑周產能達到 4648 萬人份,充分保障國內核酸檢測常態化需求。44 個新冠檢測試劑獲批,熒光 PCR 檢測法為主。截至 2020 年 8 月 5 日,NMPA 已批準了 35 家企業 44 個新型冠狀病毒檢測試劑,其中核酸檢測試劑 23 個,抗體檢測試劑 21 個,核酸檢測法包括 PCR 法、恒溫擴增法、測序法等, 其中熒光 PCR 檢測法占比 69.57%,是新冠病毒檢測的主流方法。同時 FDA 和歐盟也開通緊急使用授權,緩解新冠檢測試劑的需求,其中安圖生物、邁克生物、復星醫藥、華大基因等多個企業已經獲得 FDA 緊急使用授權,獲得歐盟認證的更是多達 268 家。

和抗體檢測法相比,核酸檢測法具有以下優點:
精準度高:核酸檢測相對抗體檢測更加精準,只要采養和分離核酸成功,除非樣品受到污染,否則基本不存在 假陽性或者假陰性。
辨識度強:能夠篩檢出尚未產生抗體的潛伏期,也能夠區分已經治愈的患者,可以作為治愈標準之一。
開發較容易:核酸檢測開發較為容易,原則上只要有病毒的基因序列,馬上就可以設計生產出識別病毒的特異 性探針,而只要將探針序列公布,所有廠商和生物試劑公司在獲得序列的數個小時內就可以開發出對應檢測試劑。
核酸檢測具有早期診斷、靈敏度高和特異性高等優點,是確診新冠肺炎的“金標準”,但核酸檢測可能會由于采樣不當、標本保存不當等原因出現“假陰性”。血清學檢測通過檢測血清特異性 IgM 和 IgG 的含量來判斷是否確診,從而彌補核酸檢測容易造成漏診的缺點。根據國家衛建委《新型冠狀病毒肺炎診療方案(第七版)》,血清學檢測與 核酸法聯合檢測作為確診病例和疑似病例的診斷依據之一。
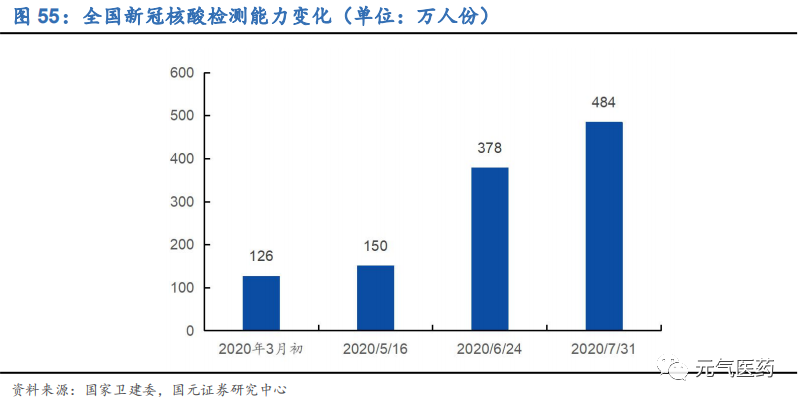
二級以上醫院建設 PCR 實驗室,核酸檢測能力將大幅提升。4 月 16 日,國家衛健委召開的全國新冠病毒疫情常態化防控工作電視電話會議中提出,要求所有縣區級以上疾控機構、二級以上綜合醫院要抓緊進行改造,建設 PCR 實驗室,在短時間內形成核酸檢測能力。根據衛健委數據,全國核酸檢測能力從 3 月初的每天 126 萬人份提高至 7 月底的 484 萬人份,可以滿足現有的檢測需求。
新冠檢測試劑集采常態化,價格降幅明顯。自 4 月 26 日湖北省首發開始進行新冠檢測試劑集中采購至今全國已有超過 10 個省份地區開展了新冠檢測試劑的集中采購,在疫情形勢尚不明朗的情況下,各省對新冠的檢測需求確定性強,在全球疫情得以控制前集采將進入常態化。目前國內生產新型冠狀病毒的核酸檢測試劑企業多達 281 家,隨著越來越多的企業加入到核酸檢測試劑的集采當中,檢測試劑的價格降幅明顯,在 6 月 15 日公布的京津冀集中采購中標結 果中,多達 11 家公司中標,最低價為 12.00 元/人份,最高 18.35 元/人份。2020 年 6 月 19 日,國家醫療保障局發布《關于配合做好進一步提升新冠病毒檢測能力有關工作的通知》,鼓勵省級和統籌地區醫保部門積極探索開展新冠病毒檢測試劑集中采購,未來集采或將成為常態。
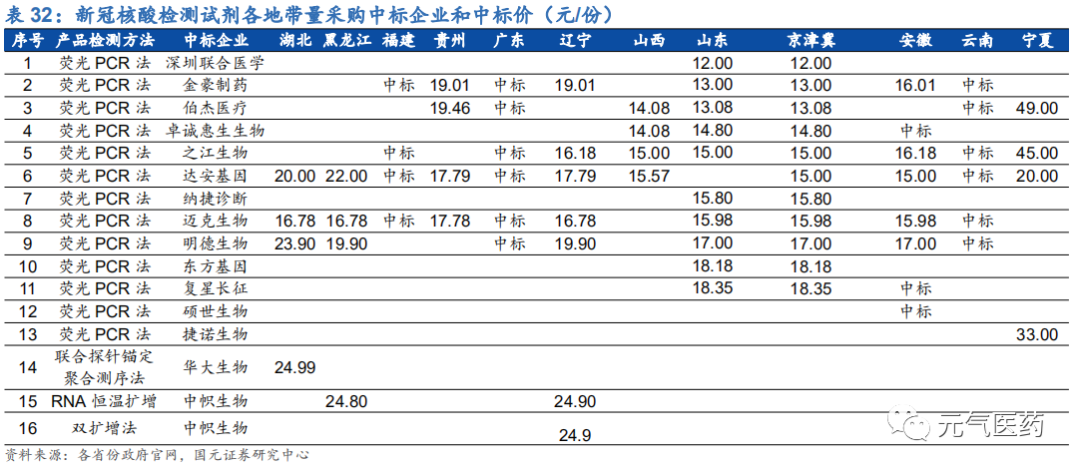
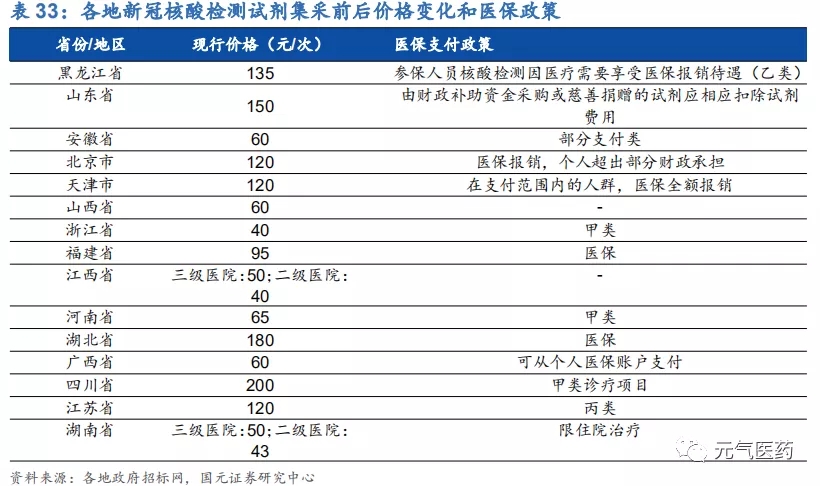
集采價格下降帶動核酸檢測費用下降,并且被納入醫保報銷目錄。各地帶量采購新冠檢測試劑價格下降后,各地相繼下調了核酸檢測費用標準,由于全國尚無統一的收費標準,而且各地采購核酸試劑成本不同,導致各地核酸檢測費用差異較大,集采之前價格普遍在 200 元/次以上,集采后價格普遍下降,其中浙江省價格最低,為 40 元/次。同時,6 月 19 日國家醫療保障局辦公室發布《關于配合做好進一步提升新冠病毒檢測能力有關工作的通知》中提出, 各地要將核酸檢測及相關耗材納入醫保報銷范圍,目前已有黑龍江、北京、湖北、福建、天津等省市已實施將新冠核酸檢測納入醫保報銷范圍。未來隨著集采常態化,核酸檢測價格或將進一步下降。
小結:大規模篩查呈常態化趨勢,檢測試劑供應商和 ICL 持續收益
目前全球新冠疫苗研已經進入 III 期臨床試驗,在有效的疫苗或特效藥出現之前,國內疫情仍存在反彈風險,作為“金 標準”的核酸檢測試劑仍然是快速篩查出新冠患者、最大程度減少新冠傳播的有力手段。從武漢全市1000 萬人的大 規模篩查,到北京出現聚集性疫情后累計對 1000 萬人進行核酸檢測,再到新疆、大連等地接連出現疫情反彈,大規 模的篩查使得新冠檢測試劑的需求激增,而對密切接觸者、境外入境人員、發熱門診患者等八類重點人群的“應檢盡 檢”以及“愿檢盡檢”的個人檢測需求也將拉動新冠檢測試劑的放量。在各地政府集采中,價格、產品質量、產能等因 素將成為各地集采的重要考量因素,邁克生物、之江生物、達安基因、明德生物等在新冠檢測試劑帶量采購中入選的企業、產能較豐富的龍頭企業的新冠檢測業務業績有望增厚。此外,迪安診斷、金域醫學也成為核酸檢測的中堅 力量,截至 7 月 21 日,迪安診斷新冠核酸檢測突破 1000 萬例,約占全國檢測總量的 1/10。另一方面,同時獲得國內認證和海外認證的新冠檢測產品出口量也會隨著海外疫情的蔓延不斷加大,預計 2020 年下半年相關企業將持續受益。
2.4.2 血液篩查市場:血篩核酸檢測高效靈敏,替代酶聯免疫成趨勢
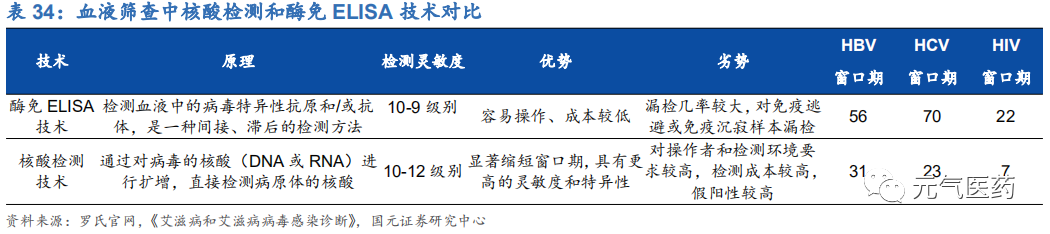
核酸檢測結果優于傳統酶聯免疫,明顯縮短檢測“窗口期”。血液篩查又稱為血源篩查,是指為了保障臨床用血的安全、血液制品的質量,防止供受血之間的交叉感染和采血及血液制品工作者的健康,必須防止相關疾病的感染者進入供血隊伍,防止上述疾病病原體陽性血漿直接輸入病人或用于血液制品生產而進行的血液篩查。據 WHO 數據示,全球每年獻血量超過 1 億人次,血液篩查產品也成為保障血液安全的必要檢測手段。根據《血戰技術操作規程 (2019 版)》要求,血液篩查目前主要應用于人類免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、丙型肝炎病毒 (HCV)、梅毒螺旋體、丙氨酸氨基轉移酶(ALT)等的檢測,其中 HIV、HBV、HCV 要求必須至少用核酸檢測法 檢測一次。早期我國廣泛使用的血液傳染病檢測方法主要為酶免檢測(ELISA 技術),但血清檢測“窗口期”較長,對處于“窗口期”的病毒感染靈敏性差,而以 PCR 技術為主的核酸檢測(NAT)具有更高的靈敏性和特異性,對 HBV、 HCV、HIV 的檢測分別縮短至 31 天、23 天和 7 天,顯著降低輸血感染病毒帶來的風險,近年來在政府積極推廣下開始普及。
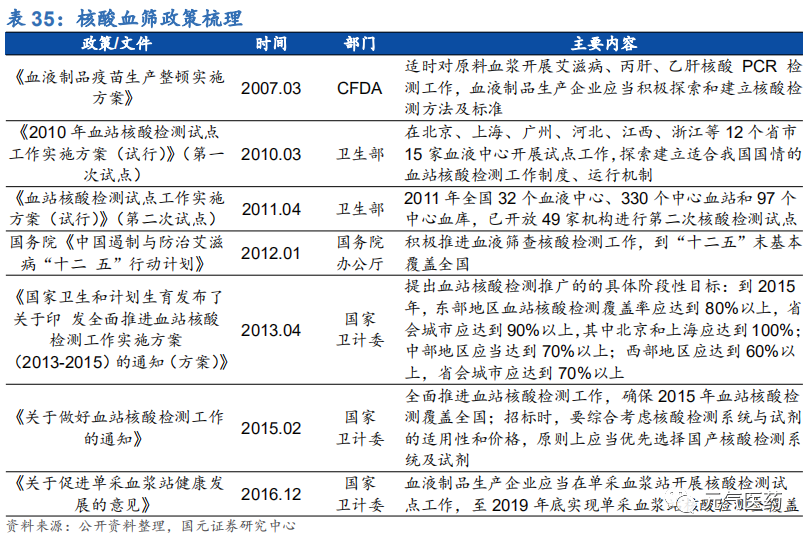
政府推動血液核酸檢測應用,已基本覆蓋全國血站和漿站。為了保障血液制品的安全,減少輸血帶來的疾病傳播風險,近些年國務院、國家衛計委等相關部門陸續出臺了多個政策,推廣靈敏度較高的核酸檢測技術在血站、漿站血 源篩查中的應用。2012 年,國務院頒布的《中國遏制與防治艾滋病“十二五”行動計劃》中便要求積極推進血液篩查核酸檢測(NAT)技術推廣工作,計劃到“十二五”末基本覆蓋全國。2013 年衛計委發布了《關于印發全面推進血站 核酸檢測工作實施方案(2013—2015 年)的通知(方案)》,提出了 NAT 推廣的具體時間表,強調 2015 年將 實現基本覆蓋全國。2016 年 12 月,衛計委和財政部聯合印發《關于做好血站核酸檢測工作的通知》,要求全面 推進血站 NAT 工作,確保 2015 年血站核酸檢測覆蓋全國,在集中招標采購方面也會優先選擇國產核酸檢測系統 及試劑。2016 年 12 月,衛計委發布的《關于促進漿站健康發展的意見》中提出 2019 年實現血漿站核酸檢測的全覆蓋。
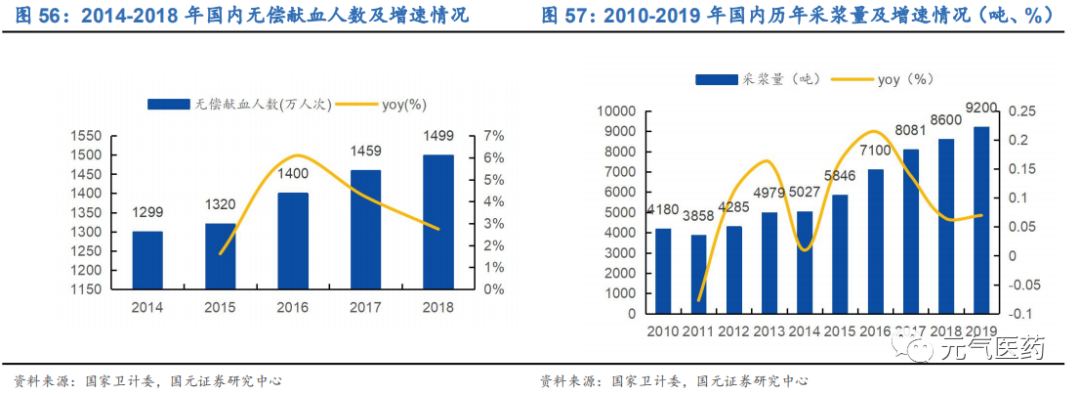
獻血人數和獻漿量逐年增加,推動核酸血篩市場規模上行。血站血篩市場方面,國內血站在 2015 年已經基本完成核酸檢測全覆蓋,2018 年我國無償獻血人次為 1499 萬人次,同比增長 2.74%,占總人口的 1.07%,而根據世界衛生 組織統計,獻血人數占一國人口總數的 4%,即能滿足全國臨床用血的需要,高收入國家的獻血率中位數為每千人 32.1 次,國內 2018 年為每千人 10.7 次,仍有較大上升空間。漿站核酸檢測方面,根據衛計委《關于促進單采血漿 站健康發展的意見》,2019 年底實現單采血漿站核酸全覆蓋,過去 10 年我國采漿量整體呈現緩慢上漲趨勢,年采 漿量從 2010 年的 4180 噸增長至 2019 年的 9200 噸,隨著疫情拉動血制品需求增加以及新建漿站的審批,采漿量有望持續穩定增長,從而帶動核酸血篩市場穩定增長。
國產核酸血篩市場競爭格局較為穩定,基本實現國產替代化。國內核酸血篩市場主要企業包括上海浩源、科華生物、華益美、達安基因、萬泰生物、圣湘生物等,各家產品同質性程度較高,因此成本控制、市場先發性、渠道合作、區域優勢等因素成為競爭的關鍵因素,科華生物憑借早期和血站建立的合作關系占據較大市場份額(30%),具有先發優勢;達安基因在 HIV、HBV 和 HCV 均有檢測試劑盒,產品線齊全,而且在獻血和采血大省廣東省具有血篩 核酸檢測區域優勢。在國內集中采購方面,國產檢測試劑盒憑借較高的穩定性和靈敏度以及成本優勢成為血站和漿站的首選供應商,目前已基本實現國產替代化。
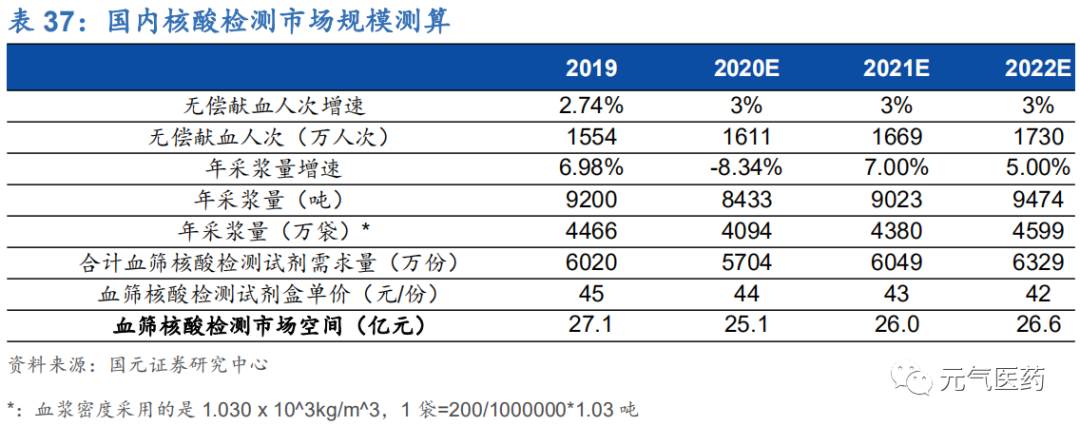
國內采血漿量存在較大上升空間,血篩市場未來市場規模約 26 億元。隨著下游各類血站和血液制品廠商對核酸檢測需求增加以及政策鼓勵血篩核酸檢測全面推廣,血篩檢測市場規模有望持續提升,根據血站技術操作規范,HCV\ HBV\ HCV 感染標志物應采用 2 遍血清學檢測和 1 遍核酸檢測,對未來 3 年國內血液篩查核酸檢測試產規模進行測 算,假設條件如下:
(1) 血液核酸檢測試劑單價:從近幾年國內血液核酸檢測試劑招標價格來看,中標價大多數位于 30-60 元/人份之 間并呈現出下降態勢,假設 20-22 年每人份(200ml)平均檢測成本為 45 元、43 元和 40 元;
(2) 無償獻血人次年增長率:近幾年無償獻血人次增速逐步放緩,2017-2018 年增速非別為 4.21%和 2.74%,假 設 2020-2022 年國內無償獻血人次年增長率為 3%;
(3) 年采漿量增長率:根據相關會議報導,受新冠疫情影響,2020 年上半年全國血漿采集量同比下滑 22%(減少 1000 噸),根據該估算數據以及 2019 年全國采漿量推算,2020 年上半年全國采漿量約為 3545.45 噸, 假設下半年全國采漿量較去年同期增加 5%,則 2020 年全年預計全國采漿量約為 8432.73 噸;考慮到后續疫情不確定性及國內新批漿站難度較大,假設 2021-2022 年全國采漿量增速為 5%。
小結:血篩市場發展成熟,未來增速放緩
血液篩查是疾病預防的重要手段,隨著核酸檢測技術的快速發展,血篩市場發展較為成熟,以 qPCR 為主的核酸檢測技術憑借檢測“窗口期”短、成本可控等優勢,成為血液篩查的主要檢測手段,在鼓勵血源核酸檢測在全國實現全面 覆蓋的政策下,核酸檢測手段逐漸普及,目前已基本實現全國血站和漿站全覆蓋。
考慮到疫情影響以及國內漿站新批難度較大,疊加核酸檢測試劑盒成本逐年降低的趨勢,未來血液核酸檢測市場增 速放緩,天花板可見,我們預計 2020-2022 年血液核酸檢測市場規模將穩定在 25-27 億元之間。
從競爭格局看,國內血篩檢測試劑銷售以政府招標為主,各家產品同質程度高,因此渠道優勢、成本優勢、儀器投放能力將成為國內廠商中標的主要因素,科華生物、達安生物、上海浩源等老牌國產企業以及羅氏、諾華等進口企業或持續受益。
2.5 消費級基因檢測市場
消費級基因檢測(Direct-To-Consumer Genetic Test)是相對于臨床級基因檢測而言,是指在沒有醫療人員參與的情況下, 通過廣告、電商、線下店直接向普通消費者銷售的的基因檢測產品,主要以低通量檢測為主,技術手段包 括 PCR 和基因芯片。在美國,DTC 檢測主要圍繞祖源(家譜、生物學祖源等)、健康、寵物、親子鑒定等維度進行檢測,檢測項目多為娛樂屬性;國內消費基因檢測起步較晚,目前主要以健康等維度為主。根據《麻省理工科技評 論》在 2019 年 2 月給出的評估,目前有超過 2600 萬消費者接受了針對祖源、健康等的消費級基因檢測。

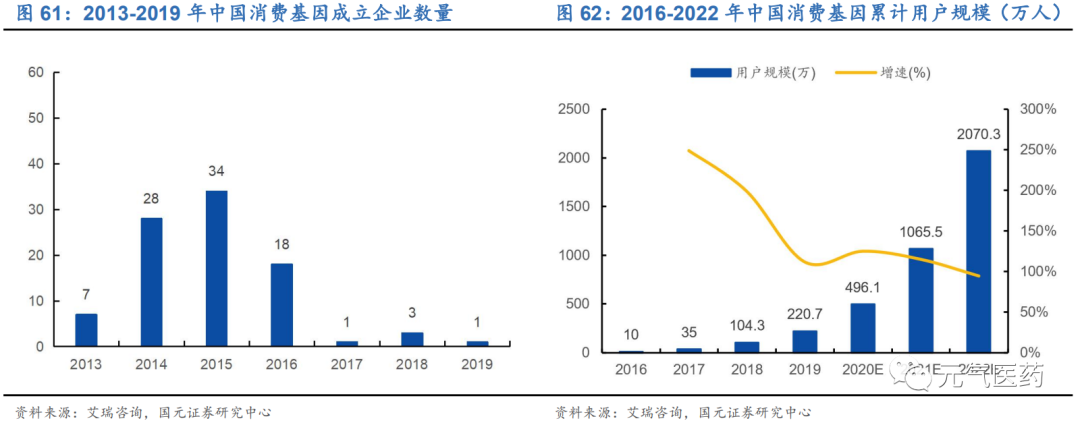
借鑒美國發展經驗,推動消費基因檢測市場提早進入發展期。消費級基因檢測市場的發展得益于基因芯片技術的成熟,1991年全球第一款基因芯片在美國誕生,此后10年內,隨著 Affymetrix、Illumina、Agilent 等公司不斷提 升芯片種類、檢測通量、準確度與效率,消費基因檢測服務價格不斷下降,帶動更多企業進入消費基因檢測領域, 市場開始慢慢進入發展期,2019 年美國消費基因檢測用戶規模達到2650 萬人,滲透率達到 8.1%,成為全球消費級基因檢測市場發展最快的國家。國內消費級基因檢測起步較晚,雖然早在 2008 年就出現了萌芽,但過高的價格促使產品滯銷。直到2015 年微基因、23 魔方等多家基于芯片技術的基因檢測公司的產品問世,國內消費級基因檢測行業才算起步。

DTC 檢測需求不斷增長,市場滲透率提升空間大。由于基因檢測技術專業化程度較高、國內監管政策不夠完善等因素,目前我國消費級基因檢測產品的消費者認知度較低。2016 年國內參與消費級基因檢測并擁有自身數據的個人用 戶總量僅約為 10 萬人,2017-2018 年高速增長,2018 年已經增長至 104.3 萬人,但滲透率也僅約為 0.07%,對比 美國 8.1%的高滲透率,我國消費級基因檢測市場滲透率提升空間較大。隨著技術創新推動測序成本不斷降低、消費者認知程度和接受度穩步提升,未來 3-5 年我國消費級基因檢測市場有望迎來“爆發性”增長。根據艾瑞咨詢數據顯示,2020 年國內消費基因檢測累計用戶規模將達到 2070.3 萬人,滲透率將提升至 1.48%。
市場格局尚未成型,市場參與者眾多且小而散。雖然目前消費級基因檢測市場規模較小,但行業競爭較為激烈,相比臨床級基因檢測,消費級基因檢測在技術、合規性等方面進入壁壘較低,市場玩家較多。據不完全統計,國內涉足消費基因檢測業務的企業數量約為 130 家,其中 2014-2016 年成立的就有 90 家,消費者認知度較高的品牌主要 有微基因、23 魔方、安我基因三家,占據絕大部分市場份額。此外,體檢中心也是國內布局消費級基因檢測企業快速滲透的途徑之一,比如美因基因利用民營體檢機構美年健康的渠道提供大眾檢測服務,目前總數據量從 2017 年的 50 萬份提升至 600 萬份。在行業發展初期,企業間用戶規模差異不大,競爭格局極易改變,未來用戶規模的增加將 是消費級基因檢測市場參與者重要指標之一。
3.投資建議及相關標的
3.1 艾德生物:腫瘤伴隨診斷龍頭,以 PCR 技術為主
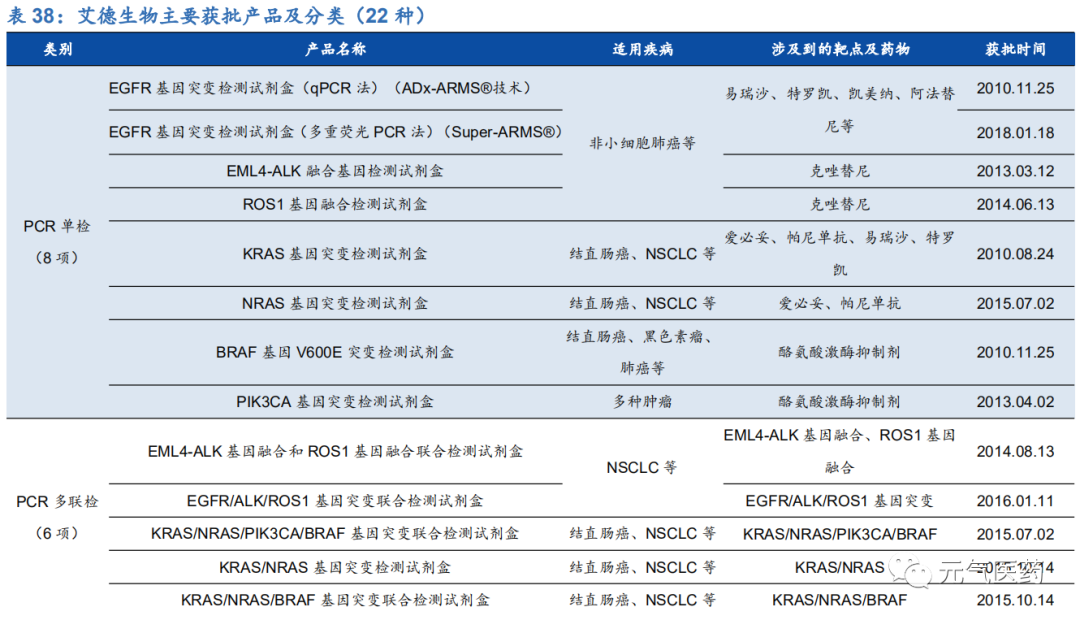
艾德生物為伴隨診斷龍頭企業,產品管線豐富,技術領先。艾德生物是國內腫瘤伴隨診斷龍頭企業,目前共有 22 種 診斷試劑獲批上市,涵蓋肺癌、結直腸癌、乳腺癌、黑色素瘤等多種疾病,全面覆蓋國內獲批的靶向藥物。公司產品種類豐富,擁有 PCR、FISH、NGS 等多種技術平臺,率先推出 PCR、NGS 多基因診斷試劑和 BRAC 1/2 診斷試劑,可更好地滿足臨床需求,目前公司產品已進入 400 多家大中型醫療機構,建立了較強的品牌效應。
PCR 技術平臺:公司基于實時 PCR 平臺先后研發出特異引物雙擴增(ADx-ARMS®)技術和 Super-ARMS 技術,覆蓋肺癌、結直腸癌、黑色素瘤三種疾病。作為國內首家獲批 EGFR 基因檢測試劑盒的公司,公司先發優勢明顯;
NGS 技術平臺:目前有 2 個產品獲批上市。2018 年 11 月獲批的人類 10 基因突變聯合檢測試劑盒(維惠健)適應癥包括 2 大癌種、5 個伴隨診斷,可同時檢測 10 個基因,覆蓋了肺癌、結直腸癌目前已上 市及擬上市的靶向藥物所需要檢測的基因變異,是國內首個跨癌種檢測產品。公司利用完全自主知識產 權的 ddCapture®技術平臺研發了人類 BRCA1 基因和 BRCA2 基因突變檢測試劑盒,填補了國內 BRCA1/2 基因臨床合規檢測的空白。

研發投入持續加大,新品研發穩步推進。公司重視新品研發,目前 SDC2 基因甲基化檢測試劑盒、PDL1 抗體試劑在國內處于技術審評階段,11 基因產品已啟動在日本臨床注冊。在 NGS 平臺領域,公司進一步加強 PARP 抑制劑伴 隨診斷領域的研發,在 2019 年國內首家獲批 BRCA1/2 檢測產品后加快同源重組修復基因突變(HRR)、同源重組 修復缺陷(HRD)檢測產品的研發,相關產品已處于科研試用階段。隨著后續新產品管線的延伸,公司業績有望持 續保持穩健快速增長。
開啟“診斷與藥物攜手”合作模式,聯手阿斯利康加強渠道下沉。自 2020 年以來,公司先后與強生、安進、達成國內市場伴隨診斷戰略合作,旨在加速公司 10 基因產品的變更注冊(擴大其伴隨診斷范圍),推動 11 基因產品在 NMPA 的注冊審批。2020 年 8 月,公司與德國默克達成日本市場的伴隨診斷戰略合作,公司公司基于 PCR 技術平臺自主 研發的“肺癌多基因聯合檢測產品”(即艾惠健®升級版)將用于默克重磅 MET 抑制劑 Tepotinib 在日本的伴隨診斷 注冊。除了伴隨診斷戰略合作外,公司與阿斯利康達成市場推廣和渠道下沉合作,借阿斯利康推廣團隊進一步擴大 公司 EGFR 基因突變檢測試劑盒、5 基因檢測產品、BRCA1/2 基因檢測產品在基層市場的滲透率,阿斯利康在國內 強大的基層市場覆蓋能力有望幫助公司肺癌產品錦衣實現放量增長。

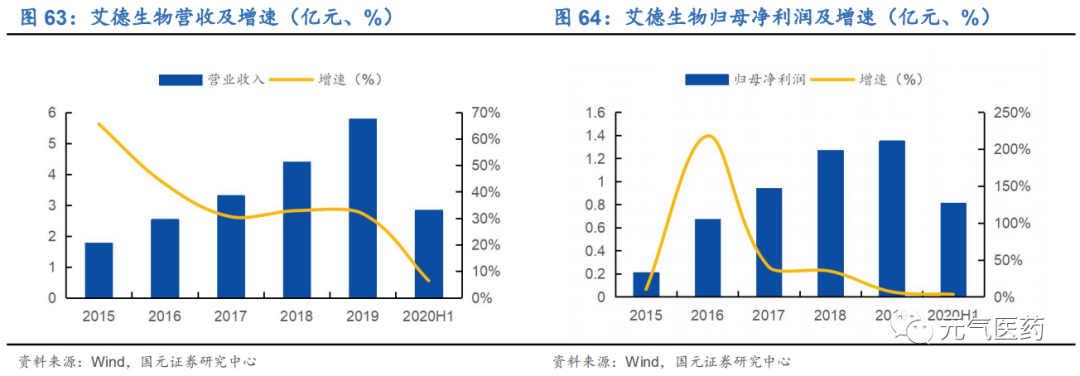
疫情影響逐漸消散,二季度業績恢復良好。2019 年公司實現營收 5.78 億元,同比增長 31.73%,實現歸母凈利潤 1.35 億元,同比增長 6.89%,實現扣非歸母凈利潤 1.17 億元,同比增長 8.30%。2020Q1 受疫情影響,醫院就診人數下降,公司收入和利潤同比下降。Q2 疫情進入緩和期,腫瘤患者就診意愿增強,公司業績實現快速增長。從單 季度業績看,公司 Q2 實現營收 1.92 億元(+31%),歸母凈利潤為 0.55 億元(+20%)。若剔除股權激勵費用 0.28 億元,則歸母凈利潤為 1.09 萬元(+24.56%)。

(更多公司情況與深入分析,請參考國元證券于 2019 年 10 月 17 日發布的深度報告《艾德生物:伴隨診斷龍頭企 業,行業保持高景氣》)
投資建議:考慮到后期腫瘤患者的回流以及公司銷售推廣的加強,預計 2020-2022 年營業收入為 7.14/9.33/11.84 億元,同比增長 23.37%/30.83%/26.89%,歸母凈利潤為 1.74/2.54/3.45 億元,同比增長 28.72%/45.54%/35.77%,EPS 分別為 0.79/1.15/1.56 元,對應 PE 為 98/68/50X,維持“買入”評級。
風險提示:疫情影響海外市場開拓;產品面臨降價風險;NGS 產品市場競爭風險。
3.2 貝瑞基因:深耕 NIPT 領域,專注遺傳和腫瘤早篩
貝瑞基因成立于 2010 年 5 月,是一家以自主研發為核心的創新型生物科技公司,始終致力于基因測序技術向臨床應用的全面轉化,公司主營業務聚焦于遺傳和腫瘤兩個方向,覆蓋無創產前診斷(NIPT)、孕前檢測、遺傳病檢測、腫瘤基因檢測及腫瘤早診早篩等全生命周期臨床需求。公司一方面通過服務模式和產品模式為各級醫院、第三方醫學實驗室等醫療機構提供醫學產品和服務,另一方面專注于用測序技術促進生命科學的研究,為科研院校、研究所 等科研機構提供基于高通量測序(NGS)的基礎科研服務。公司是國內最早布局 NIPT 領域的企業,先發優勢明顯,市場份額較高(33%左右)。此外,腫瘤全程檢測是公司近年來重點布局的領域,尤其是在腫瘤早篩領域,公司參股子公司和瑞基因與國家肝癌科學中心/南方醫科大南方醫院共同發起的全國多中心、前瞻性萬人隊列肝癌極早預警標志物篩查項目(Precar),已取得比金標準確診時間提前 6-12 個月篩查出極早期肝癌患者的成果,有望讓患者的 5 年生存率提高 5 倍以上,在國內外同類實驗中處于領先地位,該產品預計在 2021 年落地和申報注冊,或成為公司新的盈利增長點。
生育健康和遺傳病檢測領域
三級預防全面覆蓋生育健康檢測,產品類型豐富。公司在生育健康和遺傳病檢測領域產品布局完善,形成完整的三級預防體系,提供孕前及孕中攜帶者篩查基因檢測(一級)、染色體疾病篩查和產前診斷及流產物遺傳學病因檢測 (二級)、全外顯子組組測序和全基因組測序(三級)的全覆蓋檢測服務,產品類型豐富,滿足不同人群的需求。 其中 NIPT 檢測產品是公司的“明星產品”,由公司在全球率先研發并成功在臨床推廣,具有品牌優勢。
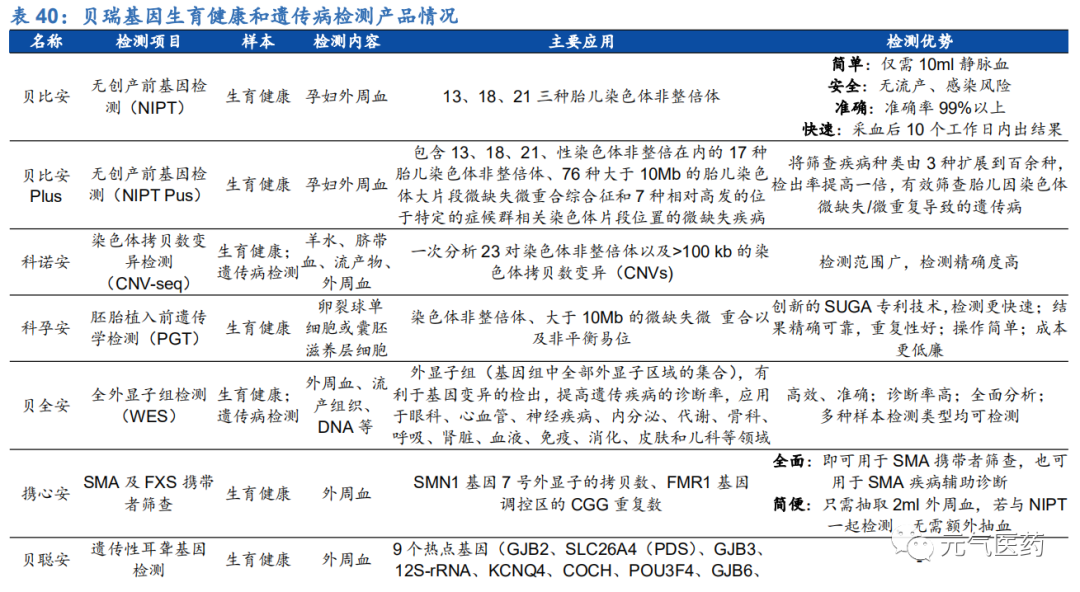

NIPT 是基因測序應用最成熟的領域,公司是最早引入 NIPT 并實現商業化的企業,和華大基因為行業雙寡頭,先發優勢明顯,產品升級、率先獲得 NIPT 產品延續注冊的優勢將鞏固公司龍頭地位。公司是最早于 2010 年把 NIPT 落地中國并成功實現商業化的企業,自 2011 年推出全球首個 NIPT 檢測產品后,憑借先發優勢、豐富的臨床數據積累 以及自身技術和平臺優勢,在 NIPT 市場處于領先地位,目前市占率在 33%左右。公司不斷擴大 NIPT 業務版圖,研發出檢測病種更多的 NIPT Plus 產品,將篩查疾病種類由三種擴展到百余種,檢出率提高一倍,進一步增加公司 競爭優勢,該產品預計 2020 年申報注冊。2019 年 8 月,公司 NIPT 產品“貝比安”完成 10 萬例臨床驗證后,順利完成產品延續注冊,目前僅有貝瑞基因一家,這需要企業同臨床機構進行大量合作、同患者進行大量規范化的隨訪,本身就具有先發優勢的貝瑞基因在率先獲得產品延續注冊后,在后續市場競爭中有望繼續保持領先地位。
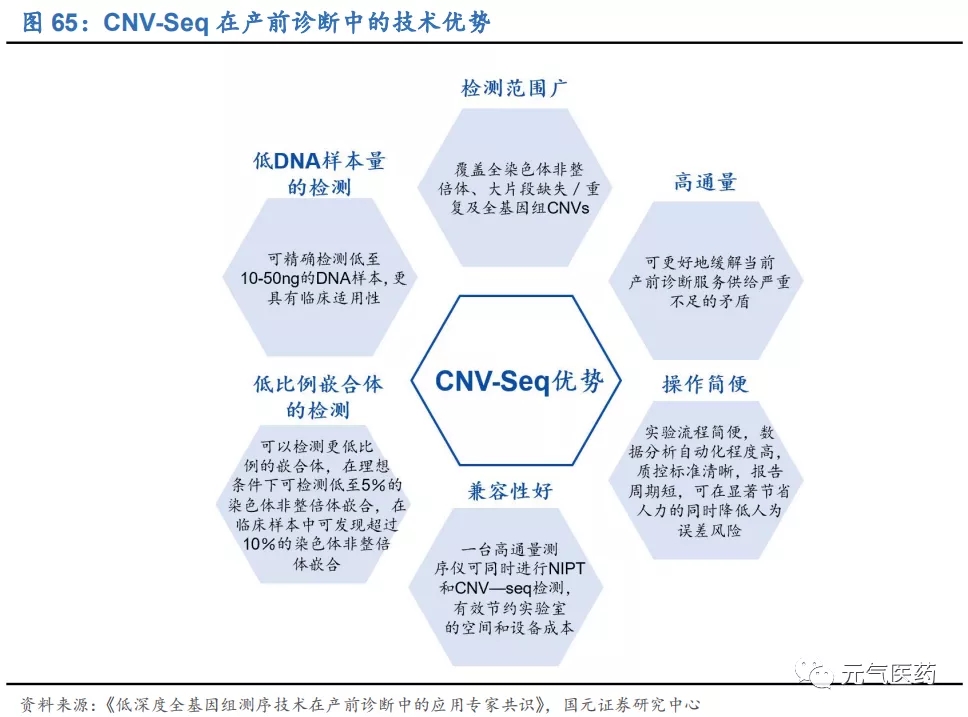
CNV-Seq 是推薦一線染色體畸變產前診斷技術。公司自主研發的“科諾安”染色體拷貝數變異檢測(Copy Number Variation Sequencing,CNV-Seq)主要用于產前診斷和流產物遺傳學病因檢測領域,在《低深度全基因組測序技術在產前診斷中的應用專家共識》中被推薦作為一線產前診斷技術對可能存在胎兒染色體異常的孕婦進行產前診斷,可檢測外周血、絨毛、羊水、臍帶、流產物等多種類型樣本,一次性分析 23 對常染色體非整倍體以及>100kb 的染 色體拷貝數變異。傳統染色體畸變檢測技術-核型分析和染色體微陣列分析(CMA)分別存在周期長、分辨率低和通 量低、成本高的缺點,相比之下 CNV-Seq 技術具有檢測范圍廣、高通量、操作簡便、兼容性好、適合低比例嵌合體的檢測和所需 DNA 樣本量低等優勢。
腫瘤學領域
前瞻性布局腫瘤早篩,肝癌早篩獨家產品有望 2020 年落地。除了成熟的 NIPT 市場,公司還積極布局腫瘤檢測領域, 2017 年公司將旗下腫瘤業務進行剝離成立和瑞基因,并戰略性地將業務向腫瘤早篩和早診延伸,將肝癌、婦科腫瘤、肺癌確定為重點研究方向。
(1)腫瘤基因檢測領域:公司已擁有 NSCLC 基因突變檢測、結直腸癌 13 基因檢測、BRCA1/2 基因突變檢測等多個產品,在研管線豐富,覆蓋伴隨診斷、腫瘤易感性檢測、預后判斷等全方位檢測項目,此外,公司參與推進“大 Panel 在肺癌靶向用藥、免疫治療等方面的伴隨診斷”的多中心研究項目將有效彌補國內大 Panel 腫瘤臨床研究實驗的空白,整體研究預計 2022 年完成。
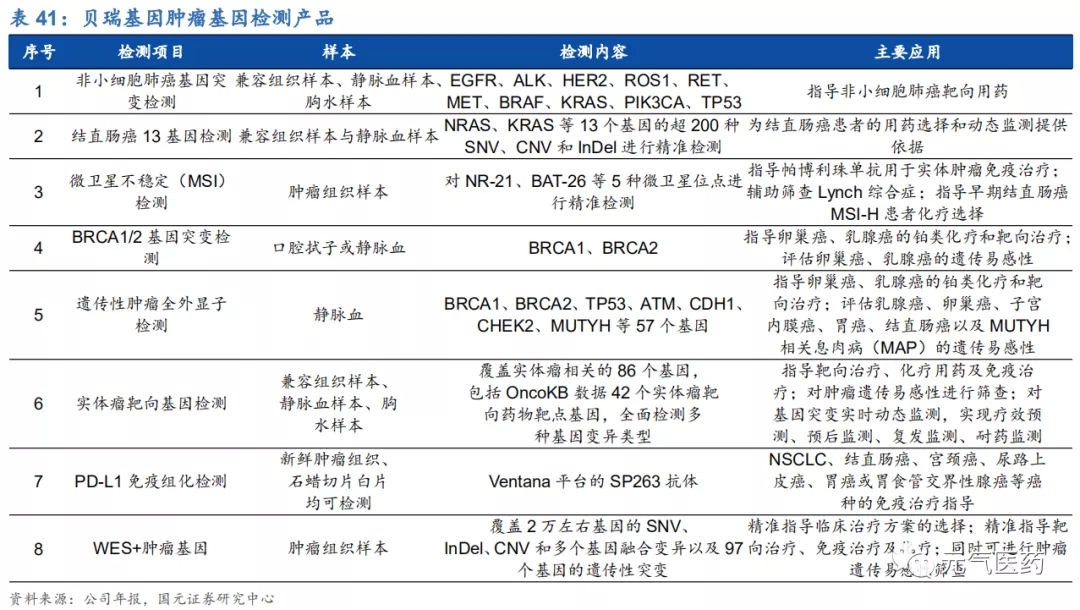
(2)腫瘤早篩領域:公司自主研發的、具有萬級技術分辨率的 cSMART 液態活檢技術已經獲得國內外專利,憑借該技術優勢,公司已成為十三五國家科技重大專項“病毒性肝炎相關肝癌人群預警和早診試劑盒及相關設備研發”的課題責任單位。公司參與的“多中心、前瞻性萬人隊列肝癌極早期預警標志物篩查項目(PreCar 項目)”已經取得較現有診斷金標準提前 6-12 個月篩查出極早期肝癌患者的試驗結果,有望讓患者的 5 年生存率提高 5 倍以上,顯示出優異的預警篩查性能,在國內外同類實驗中處于領先地位,該產品即將于 2020 年 8 月上市,或成為公司新的盈利 增長點。在測序平臺方面,2019 年公司與 Illumina 合作開發的 NextSeq CN500 測序儀適用范圍變更獲批,超越 NIPT 成為可應用于腫瘤、遺傳病等多種疾病檢測的通用型二代測序平臺,對公司腫瘤業務也是極大的利好。
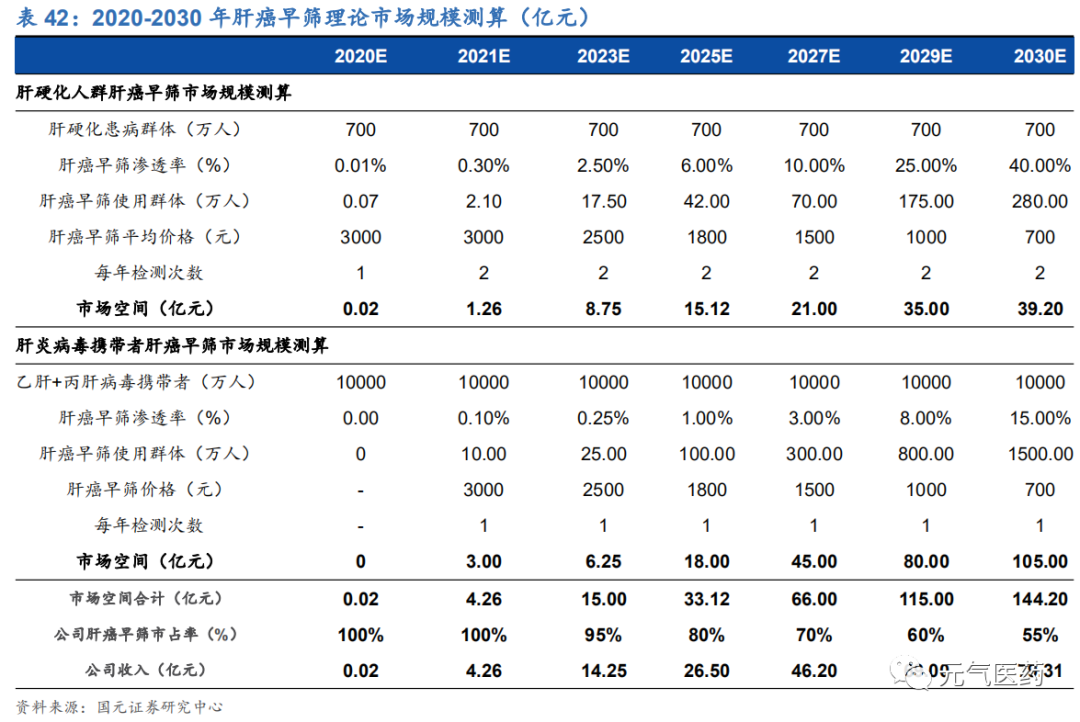
肝癌早篩主要針對高危人群,其中肝硬化患者和乙肝/丙肝病毒攜帶者是主要潛在適用群體,根據我們對未來 10 年早篩理論市場規模的測算,預計 2025 年公司收入有望超過 25 億元,2030 年有望達到 80 億元左右(滲透率 55%),具體測算邏輯如下:
(1)高危人群每年早篩次數:根據國家衛健委發布的《原發性肝癌診療規范(2019 年版)》,建議高危人群至少每隔 6 個月進行 1 次檢查,即一年檢測 2 次;由于肝癌的轉化路徑一般是“肝炎-肝硬化-肝癌”,肝硬化患者患癌風險 較高,在我們的測算中假設肝硬化患者每年檢測 2 次,乙肝/丙肝病毒攜帶者每年檢測 1 次;
(2)高危人群早篩滲透率:鑒于產品剛問世時單價仍較高,預計肝硬化人群滲透率較低,假設 2020 年滲透率為 0.01%, 逐漸上升至 2030 年的 40%;乙肝/丙肝病毒攜帶者患癌風險相對較低,假設 2021 年滲透率為 0.10%,逐漸上升至 2030 年的 15%;
(3)檢測單價:目前市場上已知泛生子肝癌早篩檢測服務終端單價為 5000 元/次,假設 2021 年公司肝癌早篩服務落地后出廠價約為 3000 元/次,隨著早篩成本降低、后續競品的出現,肝癌早篩出廠價逐年下降至 2030 年降至 700元/次;
(4)貝瑞基因市占率:公司 PreCar 早篩項目預計 2020 年以 LTD 形式落地,由于是獨家產品具有先發優勢,假設 2020 年市占率為 100%,隨著后續競爭產品的出現,公司市占率逐步下降,至 2030 年穩定在 55%左右。
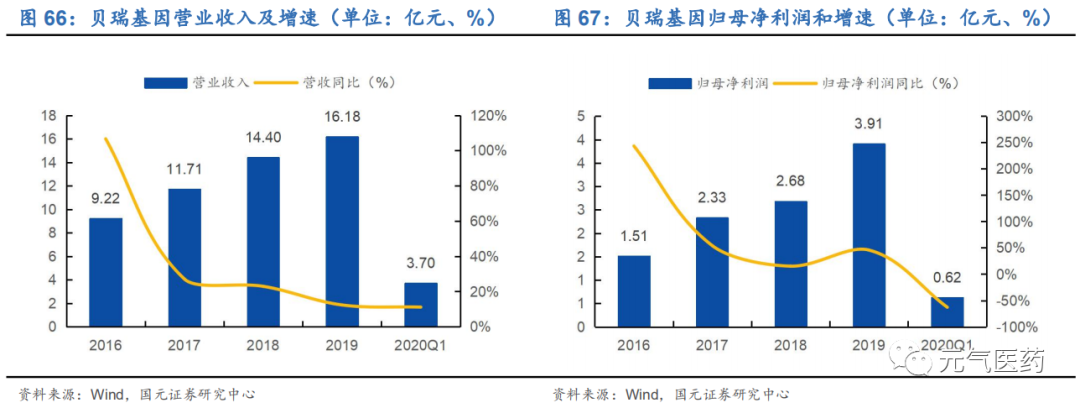
營收增長符合預期,2020Q1 受疫情影響利潤有所下滑。2019 年公司實現營收 16.18 億元,同比增長 12.35%,實 現歸母凈利潤為 3.91 億元,同比增長 45.7%,呈現穩定增長趨勢,順利完成 3 年業績承諾。2020Q1 實現營收 3.7 億元,同比增長 11.14%,主要是疫情期間醫院客流量顯著下降,導致公司檢測類業務受挫,生育類檢測業務影響 較小;實現歸母凈利潤為 0.62 億元,同比下降 62.79%,如果剔除上年同期非經常性損益 9573 萬元,扣非歸母凈利潤為 0.61 億元,同比下降 14.24%。預計二季度隨著醫院運營逐漸恢復正常,公司業績將逐步改善。
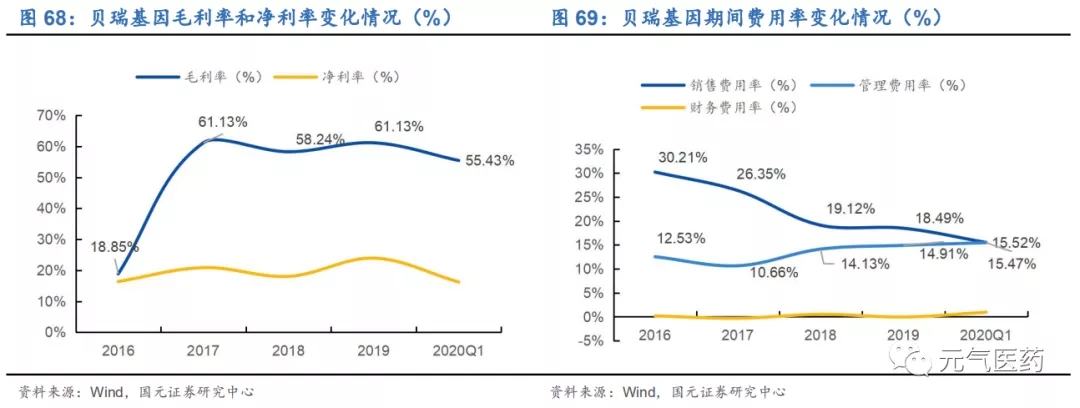
毛利率略有下滑但仍維持較高水平,三費出現小幅波動。2017-2019 年公司毛利率始終維持在 60%左右的水平, 2020Q1 受疫情影響,銷售毛利率為 55.43%,同比下降 0.83%。銷售費用率呈現逐年下降趨勢,2020Q1 為 15.52%, 同比下降 0.2pct,管理費用(含研發費用)為 15.47%,同比增加 3.46pct,主要是疫情期間公司在新冠病毒檢測及 三代測序試劑盒的研發投入增加;財務費用率為 0.95%,同比增加 1.21pct,主要系支付銀行貸款利息所致。
公司從 2010 年以 NIPT 產品研發并成功落地為突破口,逐步搭建起以測序平臺、試劑為上游,以生育健康、遺傳病、腫瘤等領域的檢測為中油,以大數據應用、消費級基因檢測等位下游的基因檢測全產業鏈。隨著 NIPT 的市場 需求正在迅速向普篩發展,以及測序成本降低、民眾意識增強、醫保支付政策鼓勵,NIPT 滲透率提升將帶動市場規模上行,根據測算,2020 年 NIPT 市場規模有望達到 100 億元,公司憑借 NIPT 領域的領先優勢,NIPT 業務有望 持續穩定增長。同時,公司肝癌早篩產品有望在 2021 年落地,具有先發優勢,有望快速搶占腫瘤早篩百億級別市 場。此外,公司憑借二代高通量測序儀 NextSeq CN500 為代表的國內主流臨床基因檢測平臺優勢,或為后續推出 更多基于測序技術的產品和服務打下堅實的基礎。
投資建議:公司是國內基因測序領先企業,腫瘤早篩試劑盒預計 2021 年落地,生育健康業務的科諾安®染色體疾病檢測產品和 NIPT Plus 預計 2021 年申報注冊,市場空間巨大。受疫情影響,檢測業務正在修復中,下半年有望逐步回暖。我們預計 2020-2022 年營業收入為 20.11/26.19/33.07 億元,同比增長 24.31%/30.26%/ 26.23%,歸母凈 利潤為 3.67/4.54/5.63 億元,同比增長-6.06%/23.75%/23.95%,EPS 分別為 1.03/1.28/1.59 元,對應 PE 為 73/59/48X,給予“買入”評級。
風險提示:新冠疫情風險;產品研發和臨床試驗不及預期;產品申報和注冊不及預期。
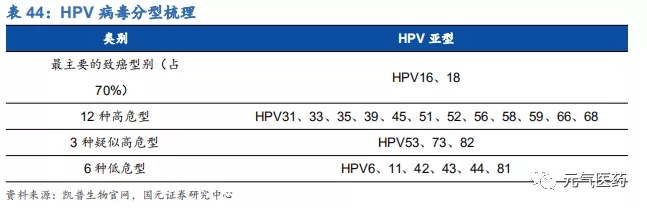
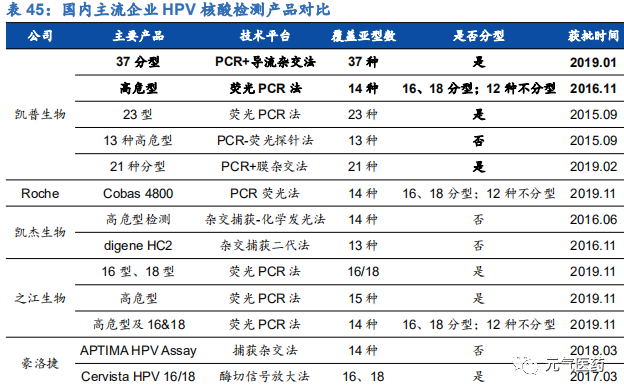
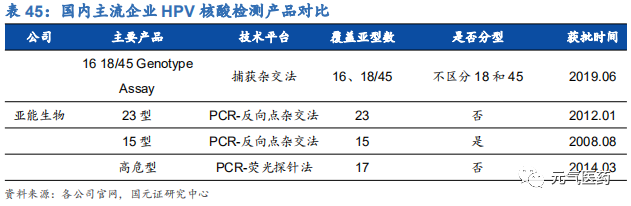
3.3 凱普生物:HPV 核酸檢測佼佼者,專注婦幼檢測領域
凱普生物是國內領先的分子診斷產品及服務提供商,在生殖感染、出生缺陷等感染性、遺傳性疾病領域已開發系列核酸檢測試劑,廣泛應用于醫院臨床診斷、大規模人口篩查,其中 HPV(人乳頭瘤病毒)檢測市占率第一,約占 1/3 市場份額,地貧、耳聾、STD(性傳播疾病)等檢測市占率均在前三。公司擁有兩大產品開發技術平臺—擁有自主知識產權的導流雜交技術平臺和 PCR 熒光技術平臺,每年研發支出 5000 萬以上,在研項目近 60 個,其中 3 個處于臨床階段的產品,4 個處于注冊申報階段的產品,每年推出 10 款左右新品,形成產品集群。經過多年的技術積累 和品牌建設,公司已發展成為國內分子診斷領域領軍企業之一。除了核酸檢測產品的研發,公司向下游產業鏈延伸, 重點拓展第三方醫學檢驗服務,打造了“核酸檢測產品+分子診斷服務”一體化經營模式,依托醫學檢驗服務領域的業務拓展進一步推動公司核酸檢測試劑業務的增長,協同效應明顯。
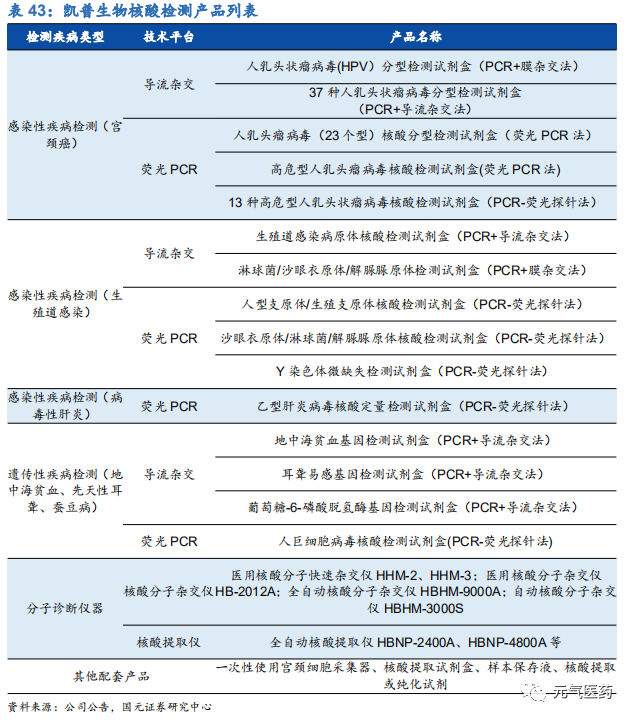
HPV 檢測產品線豐富,渠道和品牌優勢明顯。目前國內獲批的 HPV 檢測產品近百種,涉及 49 家公司,市場競爭激烈,但市場集中度較低,凱普市占率約 1/3,羅氏和凱杰等進口品牌占 1/3,其余 47 家公司瓜分剩余 1/3 市場份額。 公司強大的市場競爭力主要由于公司檢測產品線覆蓋面廣,滿足市場各類需求,和其他廠商相比,具有獲批時間早、覆蓋亞型多、精準分型、檢測時間短等優勢。主要競爭對手中,羅氏和凱杰主要在 HPV16/18 分型檢測產品上和公 司競爭,凱杰生物同時在 14 種不分型產品與公司競爭,公司除了上述產品外,還擁有 21 分型、37 分型等諸多產品, 在特定 HPV 檢測要求下具有絕對優勢。其中 HPV37 分型試劑盒是目前國內 HPV 分型最全面、可檢測亞型最多的試劑盒,國內尚無競爭對手,適合臨床診斷對全面、精準分型檢測的高端需求;HPV21 分型試劑盒 2006 年就在國內獲批,市場推廣時間最長,先發優勢明顯。此外,作為國內最早涉足 HPV 檢測市場的企業,公司具有明顯的品牌優勢,積累了深厚的渠道資源,保證了公司在 HPV 檢測領域的領先優勢。
需求端+政策雙輪驅動 HPV 檢測市場持續景氣。隨著進口四價、九價和國產二價 HPV 疫苗的陸續上市,女性對宮頸癌預防意識增強,疊加國家推出兩癌篩查政策,HPV 檢測市場有望迎來蓬勃發展,滲透率或加速提升,公司作為國內口碑和渠道資源雙贏的行業龍頭,有望率先收益,繼續領跑 HPV 檢測市場。
業績增長穩定,新冠檢測業務貢獻業績新增量。2019 年公司實現營收 7.29 億元,同比增長 25.68%,實現歸母凈利 潤 1.47 億元,同比增長 29.11%,業績增長穩健。2020H1 實現營收 5.06 億元,同比增長 59.44%,實現歸母凈利潤 1.59 億元,同比增長 115.43%。其中檢測實際銷售業務由于疫情期間醫院門診量下降,HPV、地貧、耳聾易感基因、STD 檢測試劑銷售受到一定影響,但公司第三方檢測實驗室積極開展新冠核酸檢測業務,2020 年上半年檢測 175 萬人次,實現營收 2.42 億元,同比增長高達 596.89%。
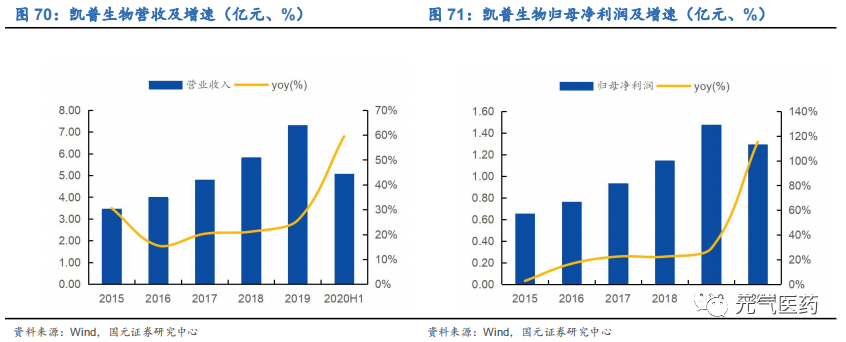
HPV 檢測產品銷售增長穩定,產品結構進一步優化。2019 年公司主要產品 HPV 檢測試劑實現營收 5.13 億元,同比增長 16.61%,占總營收比例為 70.36%,同比下降 5.55pct,整體毛利率穩定在 87-89%。公司地貧、耳聾、STD 等其他檢測試劑實現營收 1.13 億元,同比增長 39.06%,醫學檢驗服務實現營收 0.84 億元,同比增長 81.87%,增幅較大。
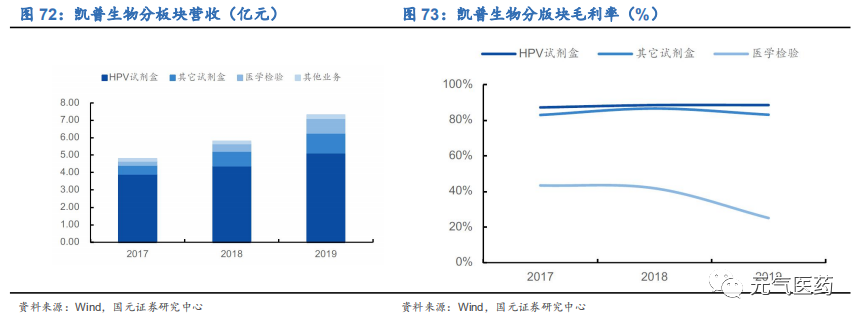
HPV 檢測滲透率有望進一步提升,持續推行“核酸 99”戰略完善核酸分子診斷產品布局。HPV 檢測是宮頸癌篩查必不可少的方式,已經推廣至婚檢、孕檢、產檢等多個場景,且隨著我國人群健康意識日益提高,檢測滲透率有望進一步提升。同時,公司提出“核酸 99”的重大戰略發展規劃,在 HPV、地貧、耳聾易感基因、STD 等優勢領域檢測試劑產品的基礎上,用 3-5 年時間加大研發投入以實現國內已上市核酸分子診斷產品的基本全面覆蓋,進一步鞏固公 司核酸分子診斷龍頭地位。STD 十聯檢獲批,或成為拳頭產品。2020 年,公司 STD 十聯檢產品獲批上市,成為國內首個獲批的十聯檢產品。目前國內 STD 基因檢測廠商眾多,獲批試劑盒月 70 多種,但基本為一聯檢和三聯檢,未能很好地滿足臨床診斷需求,而且終端收費較低,公司 STD 十聯檢產品為市場獨家,一次取樣可同步檢測 6 種性傳播疾病 10 種亞型,并對 解脲支原體進行部分分型檢測,很好契合臨床需求,公司未來有望加速搶占 STD 檢測市場,業績有望持續增厚。
公司新冠檢測試劑遠銷海外,國內加快新冠核酸檢測實驗室建設或利好公司核酸檢測服務。在新冠疫情爆發后,早 在 2020 年 2 月 3 日公司便完成了新型冠狀病毒(2019-nCoV)核酸檢測試劑的開發,并于今年 3-4 月先后獲得歐盟 CE 認證與巴西 ANVISA 認證,目前公司新冠檢測試劑盒已經出口至全球 40 多個國家。6 月 15 日,凱普生物研發 的新型冠狀病毒 2019-nCoV 核酸檢測試劑盒(熒光 PCR 法)正式列入 WHO 應急使用清單,在當前全球嚴峻的疫情形勢下,該產品的海外需求或將進一步擴大。同時,新冠疫情極大推動了核酸檢測市場的發展,國家國家衛健委 發布的《關于加快推進新冠病毒核酸檢測的實施意見》中強調所有二級以上醫院加快核酸實驗室建設,凱普作為國內核酸檢測領先企業,憑借產品線豐富、專業銷售團隊、渠道下沉深度等優勢,將在下一輪核酸檢測市場快速發展中受益。
投資建議:公司為國內 HPV 核酸檢測龍頭,HPV 檢測市場滲透率有望進一步提升,同時在疫情影響下,公司第三方檢測服務業務發力明顯。我們預計 2020-2022 年營業收入為 10.71/12.70/16.56 億 元 , 同比增長 46.90%/18.54%/30.39%,歸母凈利潤為 2.51/3.02/4.00 億元,同比增長 70.10%/20.55%/32.49%,EPS 分別為 1.15/1.39/1.84 元,對應 PE 為 44/37/28X,給予“買入”評級。
風險提示:疫情恢復不及預期;新產品研發不及預期;市場競爭風險
3.4 華大基因:基因測序領跑者,自主研發測序儀彰顯實力
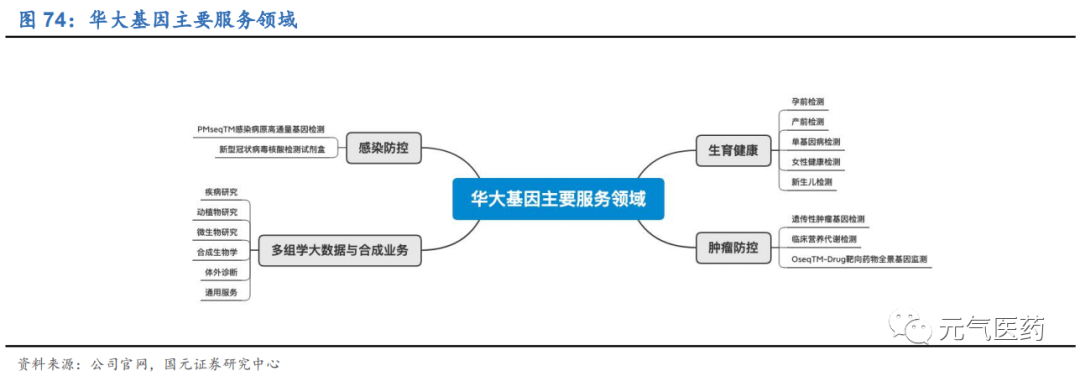
華大基因成立于 1999 年,是全球最大的基因組學研發機構,主營業務為通過基因檢測、質譜檢測、生物信息學分析等多組學大數據技術手段,為科研機構、醫療機構等幾桶研究服務和精準醫學檢測綜合解決方案,目前公司業務已經覆蓋全球 100 多個國家和地區,包括國內 2000 多家科研機構和 2300 多家醫療機構,其中三甲醫院 300 多家, 海外合作的醫療和科研機構超過 3000 家。
四大業務線布局完善,全產業鏈優勢明顯。公司產品覆蓋生育健康、腫瘤防控、感染防控、多組學大數據與合成業務四大領域:
生育健康:公司基于高通量測序儀等創新型自主檢測平臺,開展與生育健康相關的基礎研究和臨床應用服務, 涵蓋孕前、孕期、新生兒及兒童各階段,主要產品和服務包括 NIFTY®胎兒染色體異常無創產前基因檢測系列、多種單基因病無創產前檢測、EmbryoSeq 胚胎植入前基因檢測系列等近 10 個系列。
腫瘤防控:主要服務包括遺傳性腫瘤基因檢測、HPV 分型基因檢測、腫瘤標志物測定、腫瘤個體化診療等。在腫瘤臨床業務方面,公司已經與超過 400 家三甲醫院建立了長期業務合作關系,累計為超過 8 萬名受檢者提供腫瘤基因檢測服務。今年來,公司加速推出腫瘤基因檢測產品,包括遺傳性腫瘤基因檢測產品、EGFR/KRAS/ALK 基因突變聯合檢測試劑盒(聯合探針錨定聚合測序法) 、BRCA1/2 基因突變檢測試劑盒(聯 合探針錨定聚合測序法)等,產品儲備豐富。
感染防控:感染防控業務以 PMseq®病原微生物高通量基因檢測為核心產品,主要解決臨床疑難危重感染性疾病病原檢測困難、陽性率低、檢測周期長的難題。依托和各醫療機構、科研機構的合作,PMseq®檢測樣本量呈現快速增長趨勢,截至 2019 年低,PMseq®累計完成約 8.3 萬份樣本檢測。其次,公司在全球新冠肺 炎檢測中作出了突出貢獻,公司自主研發的新冠病毒核酸檢測試劑盒(熒光 PCR 法)先后獲得中國、歐盟CE、 美國 EUA、日本 PMDA 和澳大利亞 TGA 的審批認證,試劑盒訂單覆蓋 70 個國家和地區。截至 2020 年 4 月 20 日,公司檢測試劑盒日產能已提升至 200 萬人份,產能在 2 個月內擴增了 40 倍,為新冠疫情的大規模篩查提供了保障。
多組學大數據與合成業務:多組學大數據服務主要面向以高校、研究性醫院等為代表的科研機構,公司自主研 發出 DNBSEQTM 核心技術,積極推動多組學大數據業務,具有高準確度、低樣本錯混率和價格優勢等特點, 數據質量有保障。合成類業務包括基因合成、Oligo 合成和全基因組/染色體片段系統設計改造與合成服務。
NIPT 行業領導者,生育健康類業務高速發展。生育健康是公司核心業務,包括無創產前診斷(NIPT)、遺傳性耳聾基因篩查和地中海貧血基因檢測等。截至 2019 年底,公司生育產品臨床檢測累計服務近 1100 萬人次,其中 NIPT 累計超過 600 萬例,2018 年國內 NIPT 市占率為 35%,和貝瑞基因形成雙寡頭壟斷格局。
自主研發基因測序儀,向產業鏈上游布局。多年來,測序儀行業一直由 Illumina、Roche 等少數幾家外企壟斷,國內測序公司大多數處于產業鏈下游,提供測序和數據解讀服務,議價能力有限,盈利能力受限于上游測序儀生產商。2013 年華大基因收購了美國測序儀廠商 Complete Genomics,2014 年公司的 BGISEQ-100、BGISEQ-1000 基因 測序儀器及配套試劑成為國內首個獲批的基因測序儀,自 2015 年起相繼瑞出自主研發的高通量測序系統“超級測序 儀”Revolocity 和桌面化測序系統 BGISEQ-500,實現了基因測序行業全產業鏈布局。2018 年,公司發布了自主研 發的超高通量基因測序儀 MGISEQ-T7,單日數據產量可達 6TB,是全球單日生產能力最強的基因測序儀。截至 2019 年 9 月,華大制造自主研發的測序儀全球裝機量突破 1200 臺,用戶超 300 家,遍布 24 個國家和地區,實現了測 序儀的國產替代化,奠定了國產自主研發測序儀的龍頭地位。華大智造是華大基因測序儀主要供應商,建議關注后續華大智造上市情況。
業績保持穩健增長,毛利率較高
營收和凈利潤增長穩健。2015-2019 年公司營業收入保持穩定增長,從 13.19 億元增長至 28.00 億元,年復合增長 率為 20.72%,2020Q1 營業收入為 7.91 億元,同比增長 35.78%。2019 年實現歸母凈利潤 2.76 億元,同比下降 28.5%,2020Q1 實現歸母凈利潤為 1.40 億元,同比增長 42.6%。2020Q1 業績表現良好,主要系疫情影響下公司自主研發的新冠檢測試劑盒需求激增帶動業績增長。

生育健康業務為公司核心業務,貢獻公司主要收入來源。2019 年公司生育健康業務收入 11.76 億元,占比為 42.01%,是收入占比最大的板塊,多組學大數據服務于合成業務收入 6.81 元,占比 24.34%,精準醫學檢測綜合解決方案收 入 5.71 億元,占比 20.40%,這三個板塊占據了公司約 87%的收入。
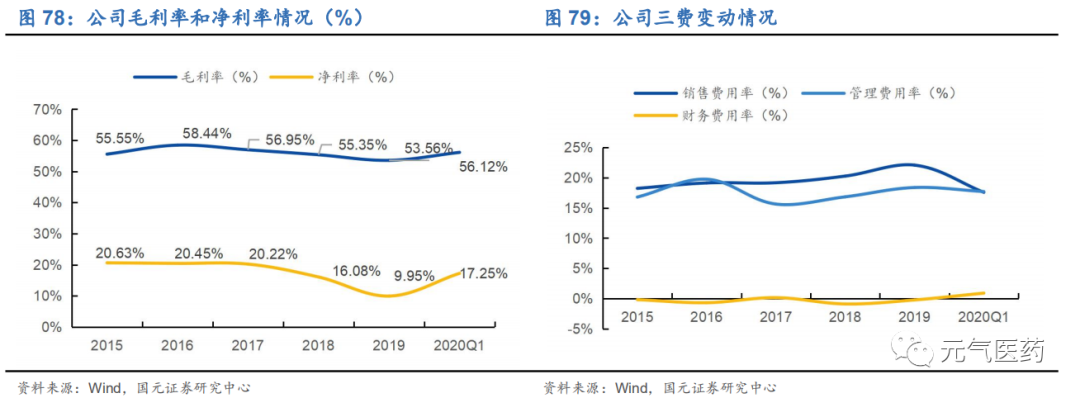
毛利率水平較為穩定,維持在 55%左右。公司 2015-2019 年毛利率基本維持在 55%左右,2019 年為 53.56%,穩中略有下降,凈利率 2019 年為 9.95%,相比 2018 年下降。2019 年銷售費用率為 22%,保持穩定增長趨勢,管理費用率為 18.38%,相比 18 年略有上升,財務費用率保持較為穩定且基本維持在 0%左右。
投資建議:公司為國內基因測序服務龍頭。上班年受疫情影響,新冠檢測業務需求激增,預計下半年疫情常態化, 公司海內外新冠檢測試劑銷售和檢測服務有望持續貢獻業績,同時公司在腫瘤全周期布局產品將加速推進,以LTD或產品形式進行商業化,驅動公司業績持續增厚。我們預計2020-2022年營業收入82.75/70.94/87.28 億元,同比增長 195.48%/-14.27%/23.03% , 歸母凈利潤 為 22.73/17.61/22.38 億 元 , 同 比 增 長 722.61%/-22.53%/27.11%,EPS 分別為 5.68/4.40/5.59 元,對應 PE 為 27/34/27X,給予“買入”評級。
風險提示:新產品研發和商業化不及預期;海外業務不及預期;市場競爭風險
3.5 燃石醫學:NGS 伴隨診斷明星企業,專注腫瘤精準治療
燃石醫學成立于 2014 年,專注于為腫瘤精準醫療提供具有臨床價值的二代測序(NGS)服務,業務及研發方向覆蓋三大領域:腫瘤患病人群檢測、腫瘤早篩和腫瘤基因組大數據生態圈。作為國內“臨檢+入院”雙管齊下業務模式的代表企業,截至 2020 年 3 月 31 日,燃石醫學已經將 NGS 檢測落地全國頂尖的 44 家醫院檢測科室,自成立以來, 燃石醫學已經累計進行了 18.5 萬次檢測。同時,公司與安捷倫科技、珀金埃爾默、Illumina、凱杰達成戰略合作, 并于阿斯利康、強生、拜耳、百濟神州、基石藥業等全球知名藥企合作提供“診斷+藥物”中國市場聯合開發推廣服務。
先發優勢明顯,公司腫瘤 NGS 檢測市 場份額第一 。2018 年 7 月,公司自主研發的腫瘤 NGS 產品 “人 EGFR/ALK/BRAF/KRAS 基因突變聯合檢測試劑盒(可逆末端終止測序法)” 獲 NMPA 批準,拿下國產“腫瘤 NGS 試劑盒第一證”,彌補了行業空白,獲得搶占市場的先發優勢。根據灼識咨詢報告顯示,在中國基于 NGS 的腫瘤基 因檢測市場上,按 2019 年接受測試的患者人數計算,公司以 26.7%的市場份額位居第一,其中肺癌患者比例達 31%。
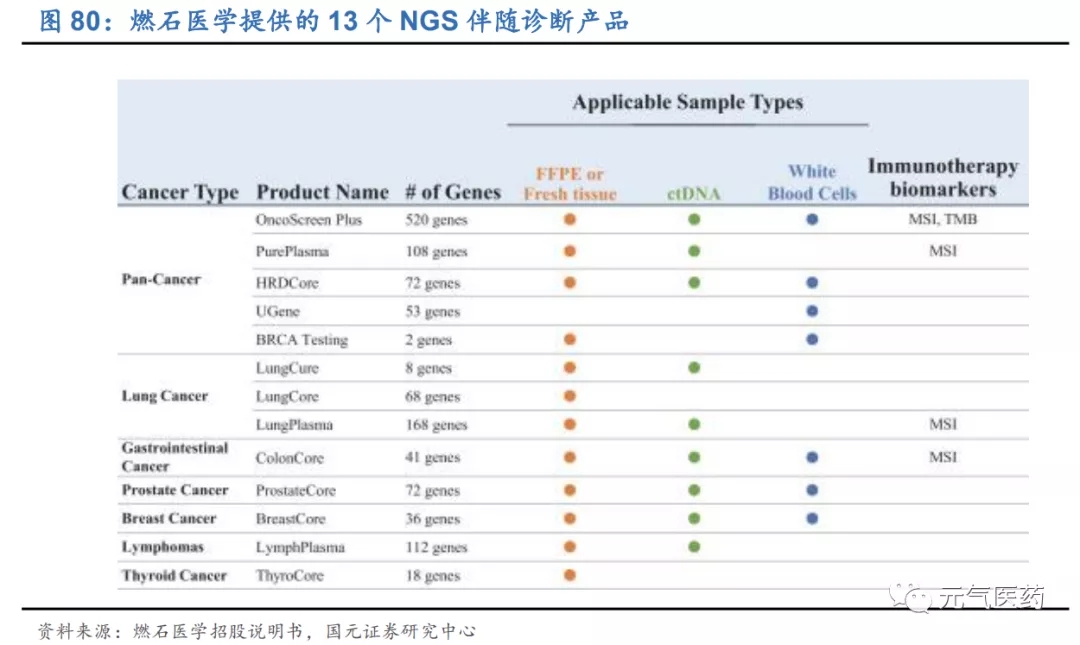
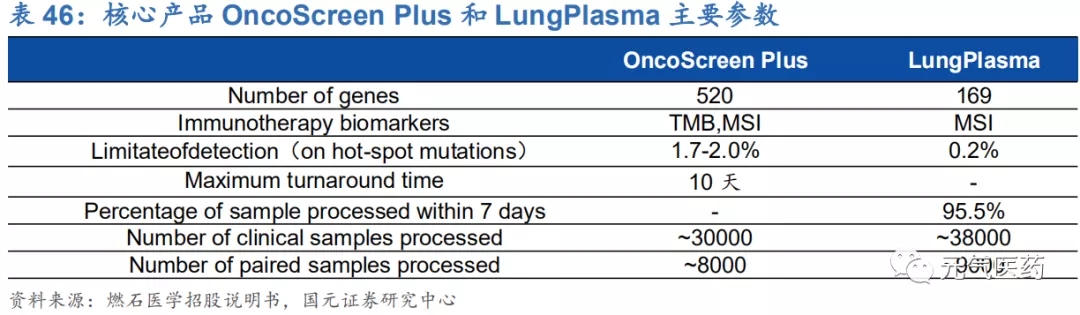
公司目前提供 13 種不同腫瘤的 NGS 伴隨診斷測試(中心實驗室檢測服務),核心產品包括泛腫瘤檢測產品 OncoScreen Plus 和液體活檢產品 LungPlasma,臨床試驗結果表現優異。其中 OncoScreen Plus 可以分析 520 多種與大多數實體瘤相關的基因,其中大多數實體瘤都有 FDA 或 NMPA 批準的治療,同時還包括了 TMB(腫瘤突 變負荷)和 MSI 指標的檢測,其設計與性能已經得到 19 個國內外領先生物制藥公司臨床試驗和研究的認可,包括 強生旗下楊森制藥、基石藥業、百濟神州等創新藥企業都使用了 OncoScreen Plus 進行臨床試驗。
公司自主前瞻性布局腫瘤早篩領域,臨床試驗結果達到全球領先水平。除了腫瘤伴隨診斷,癌癥早篩也是公司積極布局、研發投入較大、前景廣闊的領域,公司自主研發了基于 DNA 甲基化的靶向文庫制備技術 BrELSATM 和生物信息學技術 brMERMAIDTM,二者結合使得腫瘤早篩結果具有高度敏感、準確和可靠的優勢,與全球領先水平不相 上下。目前,燃石已經在 9 個主要癌種中開展了近 20 項早檢相關研究,并基于 8000 余份癌癥患者、良性病變患者 及健康受試者的組織和血液標本建立了癌癥早檢模型,這個癌癥早檢模型呈現的敏感性、特異性都已經達到了國際行業領先公司的水準。此外,燃石醫學啟動了中國首個超萬人前瞻性泛癌種早檢研究“PREDICT”,預期納入超過 14000 例受試者。
“臨檢+入院”雙管齊下,中心實驗室業務占比超 70%,院內業務呈現高增長。公司業務模式主要包括中心實驗室業務、院內業務和醫藥研發服務三塊:
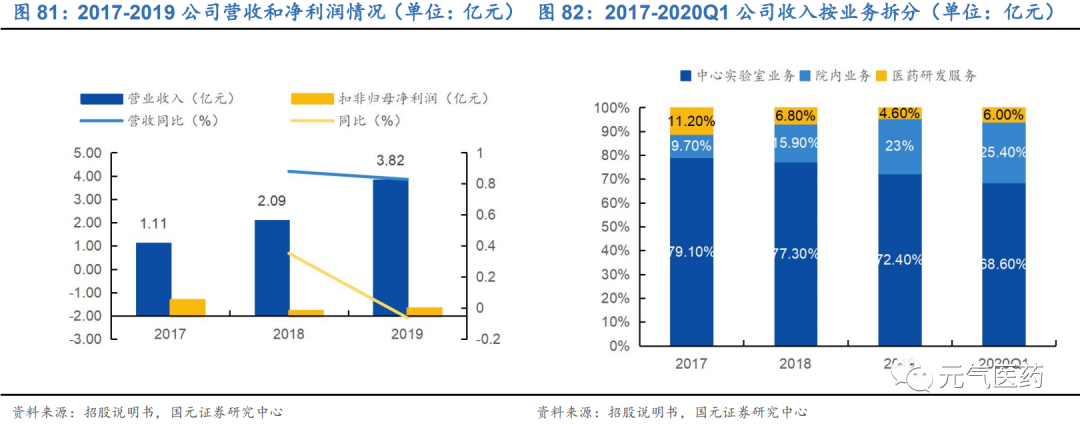
中心實驗室業務:提供腫瘤基因檢測服務,主要處理各地醫院交付給公司的癌癥患者的組織和液體活檢樣本并 發布檢驗報告,適合小型醫院,2017-2020Q1 公司中央實驗室模式分別貢獻收入為 79.1%、77.3%、72.4% 和 68.6%,是公司營收貢獻主力軍。
院內業務:主要通過合作建立實驗室、代理檢測設備以及提供試劑盒等形式,使醫院能夠自行進行檢測,適合大型醫院,目前公司已經與國內 44 家三甲醫院合作建立了院內實驗室,收入主要來自協助醫院購買實驗室設備和銷售院內試劑盒,這種模式下一旦院內實驗室、設備和系統到位,公司可以定期、重復出售試劑盒,從而 創造較高的準入門檻和客戶忠誠度,2017-2019 年分別貢獻收入為 9.7%、15.9%和 23.0%,保持穩定上升趨 勢。
醫藥研發服務:為制藥公司開發針對各種癌癥的靶向治療和免疫治療新藥,并未醫院提供癌癥診斷和治療研究,目前收入占比較少,2018-2020Q1 分別貢獻收入 6.8%、4.6%和 6.0%。
收入保持高速增長,高研發投入導致凈利潤虧損。公司 2017-2019 年營收分別為 1.1 億元、2.1 億元和 3.8 億元, CAGR 為 85%,處于高速增長的態勢。2020Q1 受疫情影響,實現營收 0.67 億元,同比下降 35.5%,主要系疫情 期間檢測服務收入下降 5040 萬元。歸母凈利潤方面,由于持續較高的研發投入,公司近三年歸母凈利潤表現欠佳, 2017-2019 年凈虧損分別為 1.31 億元、1.77 億元和 1.69 億元。
毛利率超過 60%,研發投入較高。從毛利率角度看,公司毛利率超過 60%,并且逐年穩定上升。作為一家研發驅動 性企業,公司在研發投入上始終居高不下,2017-2019 年研發費用率維持在 40-50%。
目前國內 NGS 腫瘤檢測滲透率仍然較低,主要是由于腫瘤醫生和病人對 NGS 檢測的意識較低以及靶向/免疫治療的普及性有限,未來隨著越來越多腫瘤靶向藥物和免疫藥物獲批上市,NGS 腫瘤檢測滲透率有望加速提升。此外,腫瘤用藥基因檢測項目已經被納入北京醫保,支付端上有利于 NGS 腫瘤檢測產品的快速放量。根據思略特咨詢公司預 測,僅在靶向/免疫治療伴隨診斷方面,國內腫瘤 NGS 檢測市場潛在空間可達 500-1000 億元,再加上 NGS 在腫 瘤早篩領域的發展潛力,市場前景廣闊。燃石醫學作為國內 NGS 腫瘤伴隨診斷的領先企業,憑借技術優勢和商業模 式,同時公司在腫瘤早篩這一優質賽道的產品研發也將進一步鞏固公司龍頭地位。
風險提示:產品研發不及預期,市場推廣不及預期;疫情恢復不及預期
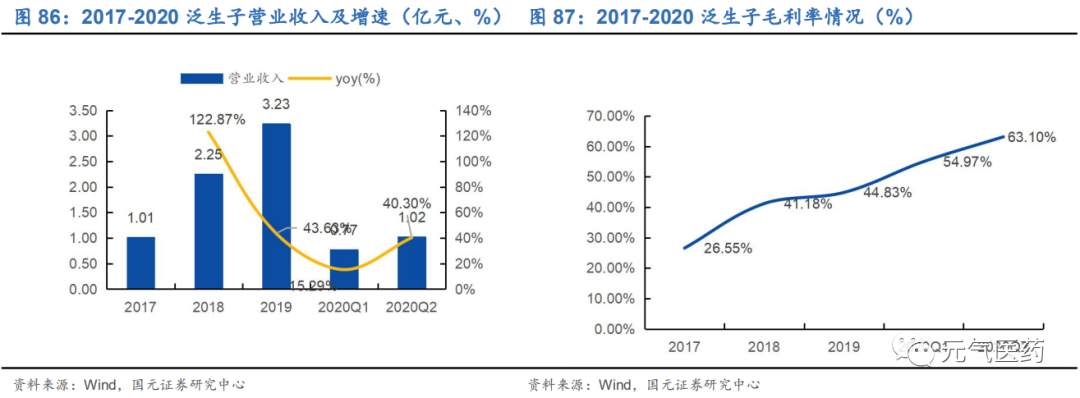
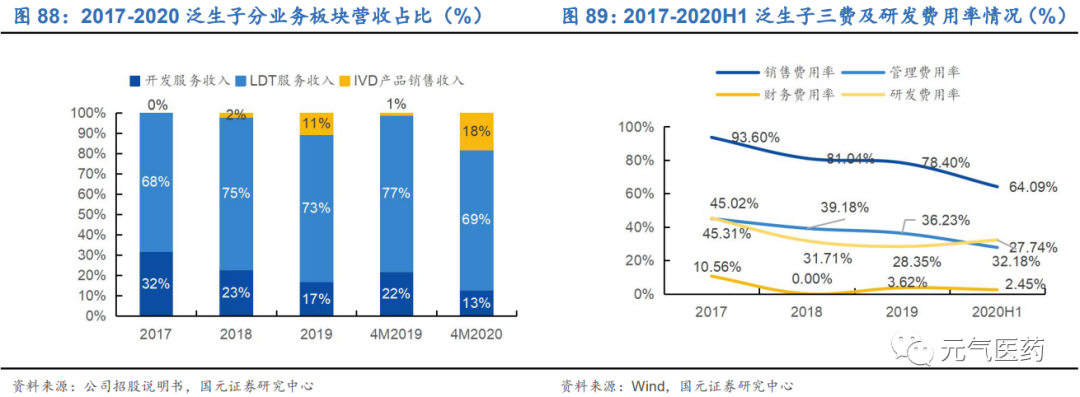
3.6 泛生子:專注癌癥精準醫療,科研+臨床協同發展
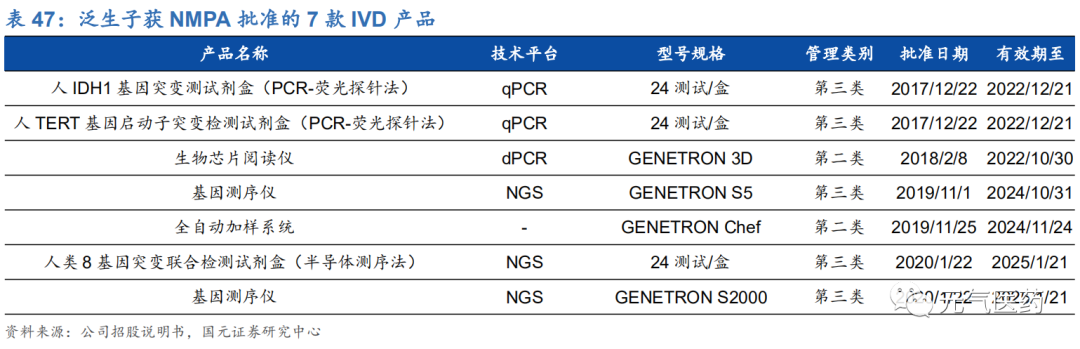
泛生子成立于 2013 年,是中國領先且快速成長的的癌癥精準醫療公司,致力于提供多應用場景的一站式分子診斷解決方案,包括癌癥早期篩查、診斷與檢測以及藥物研發服務,目前擁有 7 款獲批 IVD 產品,服務中國500 余家醫院、 數十家藥企和科研機構。同時,公司擁有中美雙研發中心,兩家通過體系認證的醫療器械生產基地和位于北京(CAP、 CLIA 雙認證)、上海、杭州、重慶和廣州的醫學檢驗實驗室。公司核心管理層擁有豐富的從業及科研經驗,包括首席科學家、美國杜克大學神經腫瘤講習教授閆海,前 FDA 資深專家胡云富博士等,研發和管理綜合實力強勁。
三大業務齊頭并進,癌癥早篩或成新增長點。公司主要業務包括診斷與監測、癌癥早篩和藥企服務:
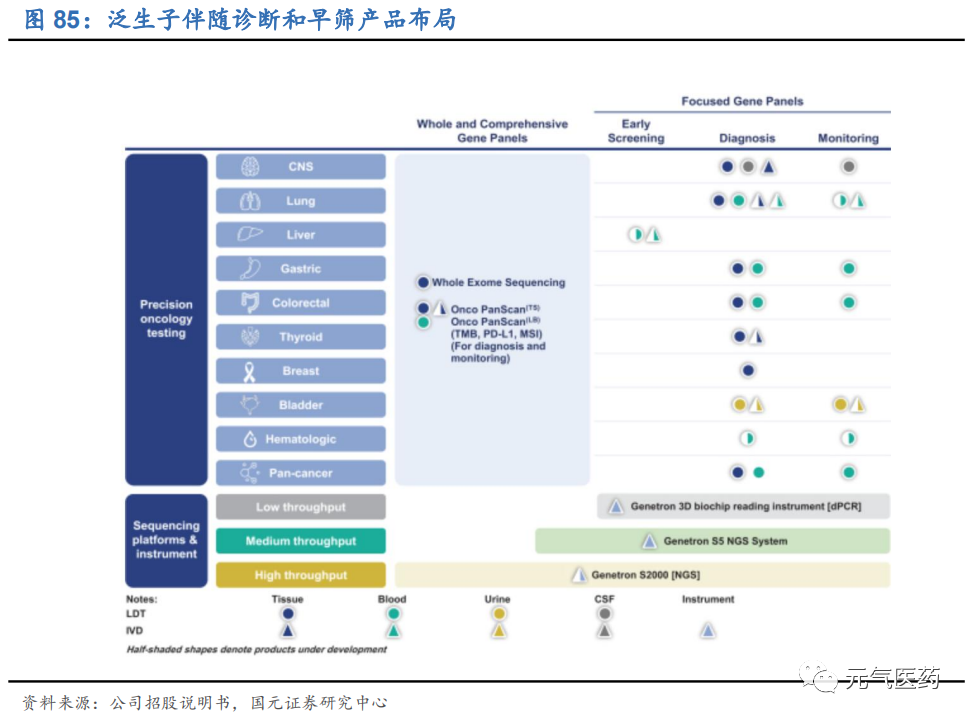
(1)布局全面的診斷與檢測業務
公司通過 LDT 服務和 IVD 產品提供全面的診斷和監控服務和產品。根據 Frost&Sullivan 數據顯示,在 2019 年基于 NGS 的 LDT 收入衡量中,公司在消化道癌和腦癌領域的市場份額領先行業,在肺癌領域也位居前三。在 NMPA 批 準產品數量上,公司共有 7 款 IVD 產品,在國內位居前列,已獲批的產品涵蓋 NGS、dPCR 和 qPCR 三大技術平臺:中通量 NGS 平臺 Genetron S5、高通量 NGS 平臺 Genetron S2000、肺癌 8 基因檢測試劑盒、神經膠質瘤的 IDH1 和 TERT 基因檢測試劑盒,以及 Genetron 3D 生物芯片閱讀儀等。公司綜合診斷產品和服務涵蓋國內十大主要癌種 中的八種,截止 2020 年 4 月 30 日,公司已經完成了 5 萬余次 LTD 診斷檢測。
LTD 服務布局全面,契合不同腫瘤患者需求。根據不同患者需求,公司已經根據 Panel 大小和不同癌種,提供了適應不同應用場景和患者需求的伴隨診斷產品系列。從檢測樣本來看,除了大多數同類企業都提供的 FFPE(石蠟包埋組織)樣品和血液樣品兩大檢測范圍外,公司還提供尿液和腦脊液檢測,在膀胱癌和腦腫瘤這兩大癌種上領先于同 行。此外,公司重磅產品 Onco PanScan 適用于所有實體瘤患者,包括新診斷的患者、耐藥患者和疾病復發患者, 可以為患者提供點突變、插入、融合蛋白、TMB(腫瘤突變負荷)、MSI(微衛星不穩定性)等全方位的評估指標, 同時還兼容 Illumina 和華大制造的測序平臺,應用場景進一步得到拓寬。
(2)癌癥早篩業務
在早篩布局上,公司以肝癌為切入點,自主研發的 HCCscreen(一種液體活檢試驗)檢測方法目前已經取得了階段性的成果。在一項 331 名無癥狀 HBV 攜帶者參與的前瞻性隊列中,HCCscreen 鑒別了 24 例陽性病例,其中有 4 例在 6 個月的隨訪中被診斷出患有 HCC,并且四例病例均處于早期(腫瘤<3cm);而其余 307 個在 12 個月的隨 訪中,都沒有肝癌發生,實現了 17%PPV(陽性預測值)、100%敏感性和 94%特異性。此外,HCCscreen 已經 在中國不同地區的多個隊列中得到驗證,顯示出 88-95%的敏感性和 94-97%的特異性。泛生子基因下一階段的肝癌 早篩研究已入圍國家十三五重大專項,其肺癌和消化道癌癥的早篩研究也已列入科技部國家重大專項。
(3)面向 B 端的藥企服務
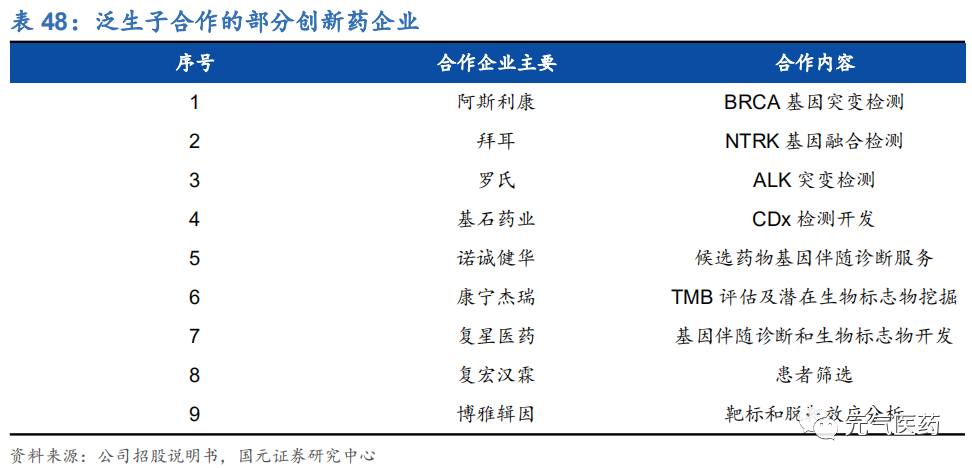
公司已經與阿斯利康、拜耳、羅氏等 26 家知名生物制藥公司合作,是國內 NGS 癌癥診斷和檢測公司合作生物制藥公司數量最多的企業,能夠提供針對分子靶向療法和免疫療法的生物標志物評估、臨床試驗入組、伴隨診斷開發, 以及藥品聯合營銷批準等定制服務和產品來滿足不同需求。前 FDA 資深專家胡云富博士的加入,將進一步強化公司 在該領域的綜合實力。
風險提示:產品研發不及預期;海外疫情風險。
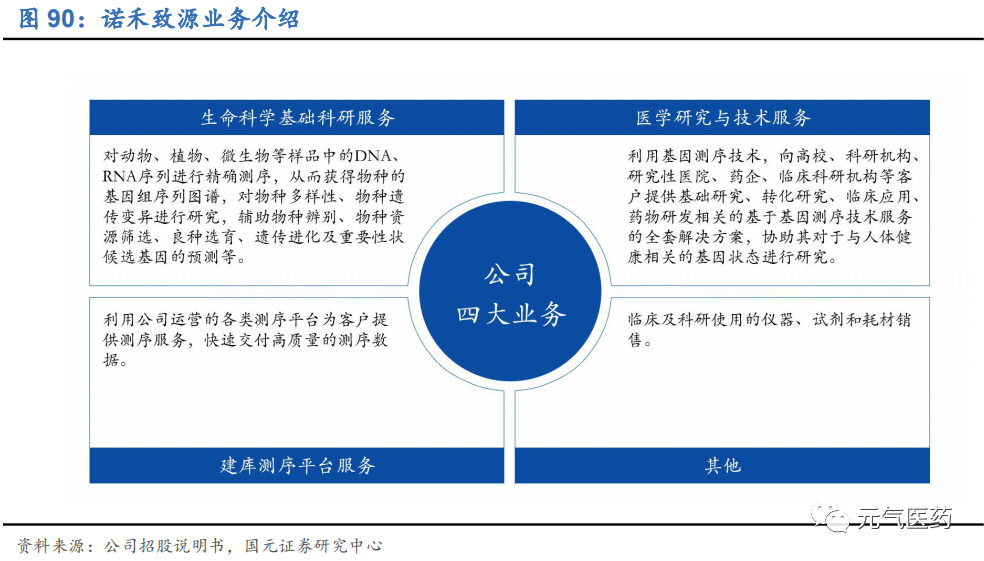
3.7 諾禾致源:深耕科研服務領域,聚焦建庫測序業務
公司于 2011 年成立,是國內通量最大的基因測序科研服務提供商之一。公司依托 NGS 和生物信息學等平臺,為高校、科研機構、研究性醫院、藥企等企事業單位提供測序服務,服務客戶覆蓋超過 60 個國家、超過 4000 家客戶。公司主營業務分成生命科學基礎科研服務、醫學研究和技術服務和建庫測序平臺服務三塊。
公司聚焦于科研服務,以建庫測序業務為核心。公司三大業務板塊均聚焦于科研服務:
生命科學基礎科研服務:是公司的主要業務板塊,為動物、植物、微生物等領域研究者提供從基因測序到生物 信息學分析的一整套基因組學解決方案;同時,公司也提供非測序技術相關的解決方案,例如基因分型、蛋白 質組學和代謝組學服務等;
醫學研究與技術服務:針對醫學相關的基因研究與技術服務,協助科研機構、高校、研究性醫院、藥企等客戶 對與人體健康相關的基因狀態進行研究,是公司重點布局的業務板塊之一。
建庫測序平臺服務:主要對客戶提供的合格樣品進行建庫并運用高通量測序平臺測序,或者對客戶提供的合格 文庫直接進行測序,并交付測序數據,由客戶自行進行生物信息學分析。
公司核心競爭力在于數據庫和數據分析。公司最近 5 年在國際期刊累計發表論文 75 篇,取得基因測序技術相關發明專利 32 項,主要集中在生物信息分析和建庫方面,表明公司在數據分析領域具有較強的研發實力。
除了科研服務外,公司積極開拓基因檢測在臨床業務的發展,2018 年 8 月公司自主研發的“人 EGFR、KRAS、BRAF、 PIK3CA、ALK、ROS1 基因突變檢測試劑盒(半導體測序法)”獲 NMPA 批準上市,成為國內首批獲準上市的基于 NGS 的腫瘤基因檢測試劑盒之一,同時也是國內檢測基因突變位點最多、臨床試驗樣本量最大的基因檢測產品。此外,公司“人 EGFR 基因 T790M 突變檢測試劑盒(數字 PCR 法)處于注冊申報階段。
公司整體營收高速增長,逐步打開海外市場。公司 2017-2019 年分別實現營收 7.39 億元、10.53 億元和 15.35 億 元,年復合增速為 44.08%,保持較高增長態勢;2019 年實現歸母凈利潤為 1.14 億元,同比增長 17.7%。從營收結構看,生命科學基礎科研服務收入占比最大,但公司醫學研究與技術服務占比逐年減少,建庫測序平臺服務逐年增長,可以看出公司著力發科研服務,臨床業務并沒有成為公司發展核心業務。此外,公司 2017-2019 年海外業務 占比逐年提升,海外市場的進一步拓展有望增厚公司業績。
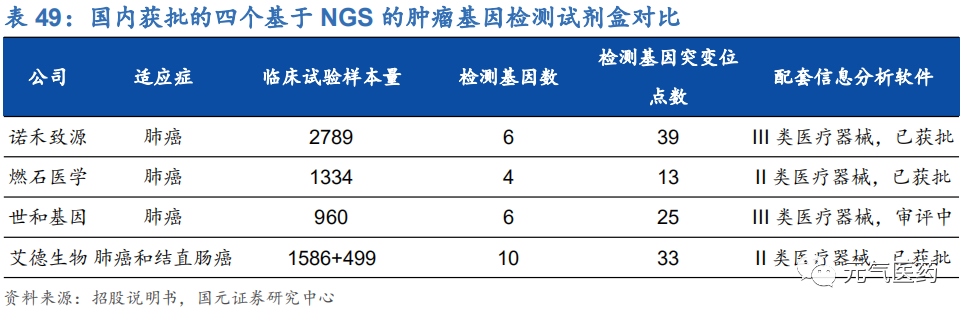
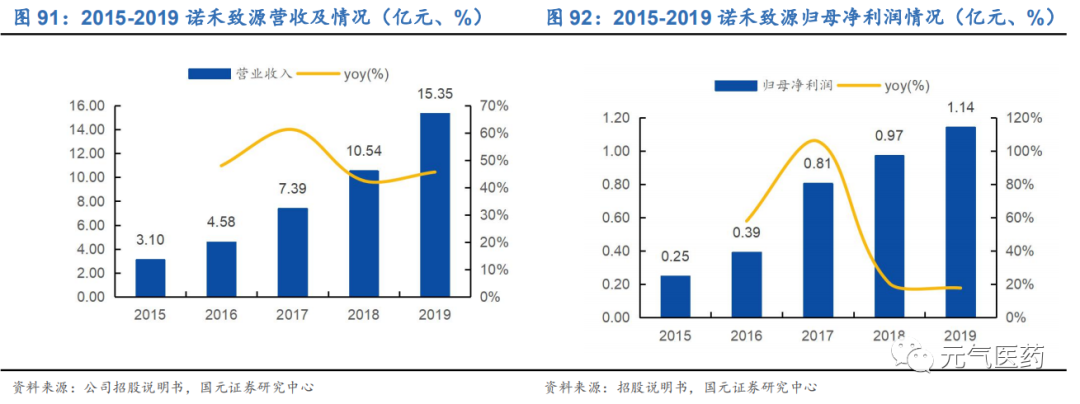
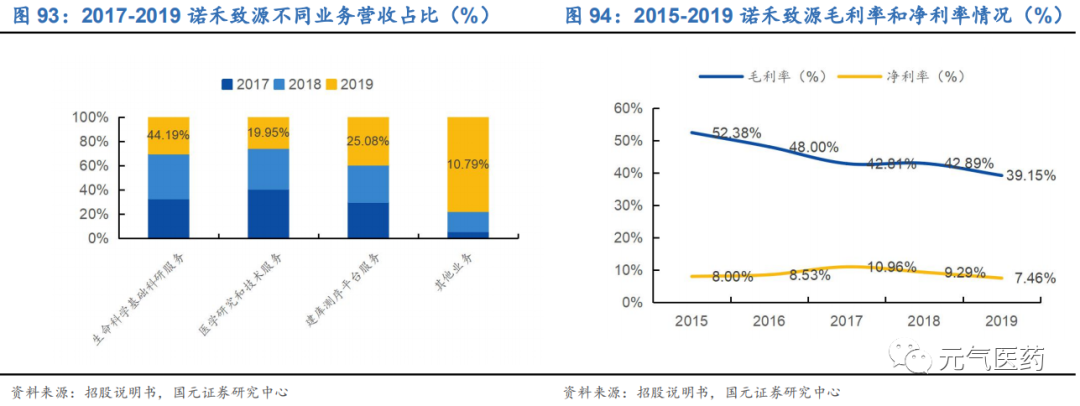
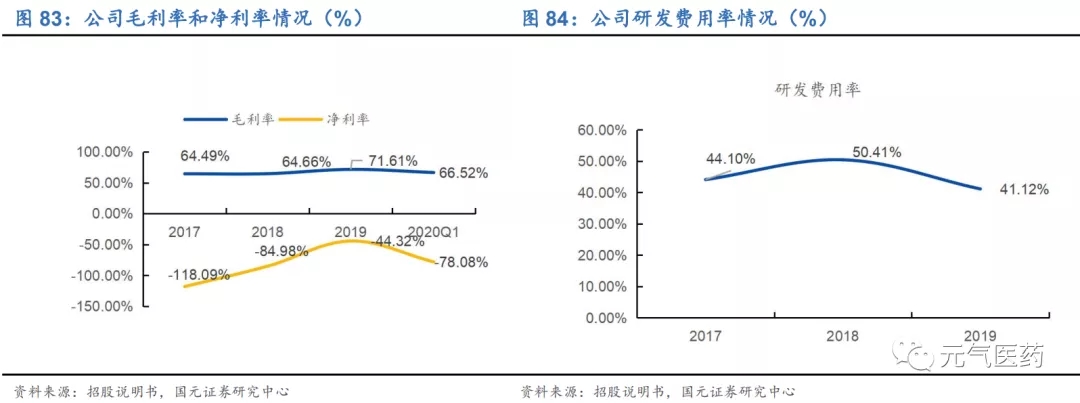
毛利率低于行業平均水平。2017 年-2019 年,諾禾致源的綜合毛利率分別為 42.81%、42.89%和 39.15%,和行業毛利率平均值有一定差距,系毛利率相對較低的自建庫業務及其他業務規模有所擴大所致。從不同業務板塊毛利率看,生命科學家出科研服務毛利率從 2016 年的 58.14%下降至 2019 年的 50.04%,建庫測序服務的毛利率從 2016 年的 37.53%下滑至 2019 年的 24.53%。
風險提示:產品研發不及預期;產品上市不及預期;海外市場拓展不及預期;疫情風險。